Amadeo Avogadro
Elhuyar Fundazioa
Físic italià nascut a Torí, Piemont, el 9 de juny de 1776.
Va estudiar dret i en 1800 va començar a estudiar matemàtiques i física. Com ell va treballar en profunditat les ciències, exercint la docència. En 1809 va ser nomenat professor de matemàtiques i física en el col·legi real de Vercelli i a partir de 1820 professor de física superior en la Universitat de Torí.
Segons la troballa de Gai-Lussac, a mesura que la temperatura augmentava, tots els gasos es distribuïen en la mateixa proporció, i Avogadro, estudiant-ho, va tenir una idea. Considera que tots els gasos havien de tenir el mateix nombre de partícules per unitat de volum a una temperatura determinada. Aquesta idea va ser traslladada en 1811 i va comentar amb molta cura que les partícules esmentades no tenien en què consistien els àtoms individuals. També podien existir combinacions atòmiques (les que avui diem molècules).
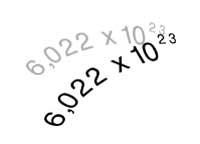
A partir d'aquí va explicar amb facilitat la llei de combinació de volums de Gai-Lussac. XIX. A principis de segle Ritter va electrolitzar l'aigua recollint l'oxigen i l'hidrogen separats. Va poder comprovar que el volum d'oxigen era la meitat que el de l'hidrogen. Avogadro va demostrar llavors que, aplicant la seva hipòtesi, la molècula d'aigua tenia dos àtoms d'hidrogen i un àtom d'oxigen. Si el pes total de l'oxigen recollit era vuit vegades major que el de l'hidrogen, l'àtom d'oxigen era setze vegades més pesat (i no, segons Dalton, vuit vegades més pesat).
No obstant això, les idees d'Avogadro no van ser preses en consideració en les pròximes dècades. Dalton les va abandonar i el químic més famós de l'època, Berzelius, va arribar fins al càncer. Com a conseqüència d'això, els químics van tenir grans mescles, inseparables àtoms, molècules, pesos atòmics i pesos moleculars.
Estanislao Cannizzaro va ser el primer que va tenir en compte a Avogadro, dos anys després de la seva mort, i va anar llavors quan va aconseguir la reputació que la ciència turista li va negar en la seva vida.
En l'actualitat és conegut com Avogadro, perquè el número que porta el seu nom serveix per a calcular quants àtoms (o molècules) té el pes atòmic expressat en grams. L'òxid de carboni (IV), per exemple, té un pes molecular 44 i en 44 grams d'aquest gas hi haurà tantes molècules com el número d'Avogadro, és a dir, 6,022x1023 molècules (602.600 molècules de trilión).
També s'utilitza en Química per a definir el mol. Un mol de substància és la quantitat que conté 6,022x1023 unitats d'aquesta substància.
Avogadro Quaregna i Conde de Ceretto durant la seva vida, va morir a Torí el 9 de juliol de 1856.





