Definizio-saltsa

Astun hitzak dentsitate handikoa esan nahi du ohiko erabileran. Metal hitzak, berriz, elementu purua edo elementu metalikoen aleazioa adierazi nahi du. Metal astun izendapena urteetan erabili da, baina zalantza eragiten du adituen artean. Beharrezkoa da metalak definitzeko edo sailkatzeko? Alegia, zaku horretan sartzen diren elementuek badute nolabaiteko talde-izaerarik?
Gas nobleak, esaterako, taula periodikoko 18. taldeko elementuak dira. Guztiak atomo egonkorrak dira, eta kimikoki erreaktibotasun urria dute. Horrek nolabaiteko talde-izaera ematen die. Metalak, berriz, elektrizitatea eroateko gai diren eta distira metalikoa duten elementuak dira. Halaber, katioiak era ditzakete eta oinarrizko oxidoak dituzte. Ezaugarri horiek guztiak berdinak dituzte. Dena den, definizio horrek, beharbada, ez du ezer asko argitzen. Izan ere, definizio horren arabera, taula periodikoko elementu gehienak izan daitezke metalak. Horregatik, metalak talde txikiagoetan banatzen dira, bakoitzaren berezko ezaugarrien eta erabileraren arabera. Bereizketa horretan ageri dira, hain justu, metal astunak; kimikarien artean urteetan erabili izan da izendapen hori, eta gaur egun ere erabiltzen da, nahiz eta hamaika zalantza sortzen dituen. Pentsa, Kimika Huts eta Aplikaturako Nazioarteko Batasunak (IUPAC) oraindik ez du eman horien definiziorik (Kimikaren alorrean erreferentziazko erakunde arauemailea da, eta, besteak beste, konposatu kimikoak izendatzeko arauak ezartzen ditu). Are gehiago, metal astunen definizioaren inguruan dagoen eztabaidaren berri emateko zenbait txosten argitaratu ditu.
Irizpide jakinik ez
IUPACen txosten baten arabera, urteetan irizpide ezberdinak hartu dira kontuan metal astunak definitzeko. Besteak beste, dentsitatea, masa atomikoa, zenbaki atomikoa eta toxikotasuna erabili izan dira irizpidetzat. Hala, bibliografian definizio bat baino gehiago biltzen dira. Dena den, izendapena inolako irizpide jakinik gabe erabili izan denez urteetan, definizio batzuen eta besteen artean kontraesanak ere badira. Halaber, metal astun izendapena erdimetalentzat ere erabili izan da, hala nola artsenikoarentzat, kasu batzuetan. Ez dago ezer garbirik, beraz.
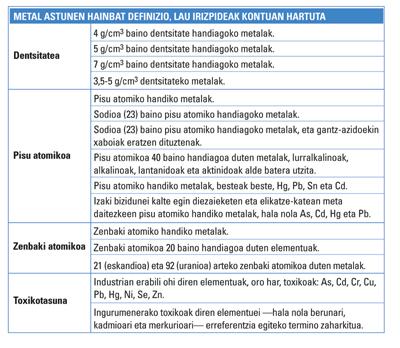
Bitxia dirudien arren, metal astun izendapena arma handiak edo talentu edo gaitasun handiak adierazteko erabiltzen zen 1936ra arte. Elementu kimikoei dagokienean, berriz, terminoaren inguruko aipamenik zaharrenetarikoa urte hartan bertan Londresen argitaratu zuten Bjerrum-en Inorganic Chemistry liburuaren hirugarren edizioan azaltzen da. Dena den, definizio hura ez da geroztik erabili argitalpenetan. Bjerrumek emandako definizioak elementuen dentsitatea hartzen zuen irizpidetzat. Hain zuzen ere, 7 g/cm 3 baino dentsitate handiagoko elementuak jotzen zituen metal astun. Urteekin, definizio hori aldatzen joan da, dentsitatearen muga aldatuz.
Dentsitatearen araberako sailkapenak erreaktibotasunarekin zuen lotura, baina, halako batean, aditu batzuek ikusi zuten dentsitateak ez zuela berebiziko garrantzirik metalen erreaktibotasunean. Hori dela eta, definizioak masa edo pisu atomikoa oinarri hartuta moldatu dira. Horrek taula periodikora hurbildu du definizioa, nolabait. Alegia, elementu kimikoen sailkapenari buruzko informazio-iturri ezagunenera. Hala ere, ez pentsa, masaren araberako irizpide hori ere ez dago batere argi.
H. Bennet eta R. J. Lewis editoreen arabera, esaterako, sodioak (Na) baino masa atomiko handiagoa, hau da, 23 baino handiagoa, duten elementuak jo daitezke metal astuntzat; beraz, magnesiotik (Mg) aurrerakoak. G. M. Randek eta haren taldeak diote, berriz, 40 baino masa atomiko handiagoa duten elementuak direla metal astunak; alegia, eskandiotik (Sc) aurrerakoak.

Beste definizio batzuk zenbaki atomikoan oinarritzen dira. Horien artean, aditu edo definizio gutxi batzuk behintzat bat datoz: metal astunak zenbaki atomikoa 20 baino handiagoa dutenak dira, alegia, sodiotik (Na) aurrerakoak. Dena den, arazo txiki bat dago: talde horretan sartzen dira magnesioa (Mg) eta potasioa (K) adibidez, eta bi horien dentsitatea oso txikia da. Alegia, ez dator bat dentsitatea irizpidetzat hartuta aipatutako definizioarekin, inolaz ere. Ezta dentsitatearen muga baxuenetarikoa oinarri hartuta ere.
Toxikotasuna da metal astunak sailkatzeko orduan askotan erabili den beste irizpideetako bat. Bestelako oinarririk gabe, ingurumenerako toxikoak direlako, metal astuntzat hartzen dira zenbait elementu, hala nola beruna (Pb), kadmioa (Cd) eta merkurioa (Hg), eta haien konposatuak.
Hala ere, metal astunen toxikotasuna, oro har, ez dago lotuta haien berezko ezaugarriekin, baizik eta haien kontzentrazioarekin. Are gehiago, maiz, eratzen duten konposatuaren araberakoa da toxikotasuna. Esaterako, eztainuaren eta tribultileztainu oxidoaren ezaugarriak oso ezberdinak dira. Lehenaren toxikotasuna oso txikia da; bigarrena, ordea, nahiko toxikoa da. Antzeko zerbait gertatzen da kromoaren kasuan ere. Kromoa ez da toxikoa altzairu herdoilgaitzean; kromato ioia, berriz, biriketako minbiziarekin lotzen dute adituek. Horra hor, beraz, metal astunen kontzeptua baztertzeko arrazoi bat. Izan ere, ez du zentzu handirik metalak nahiz haien konposatuak toxikotasunaren zaku berean sartzeak.
Zaharkitutako terminoa

Hamaika definizio, hamaika zalantza eta ezer garbirik ez. Alegia, metal astunentzako talde-izaera argirik ez. Izan ere, metalek zenbait ezaugarri komun izan arren, bakoitzak bere ezaugarri fisiko-kimikoak ditu. Ez hori bakarrik; horietako bakoitzak hainbat konposatu era ditzake, eta konposatu bakoitzak ere bere berezko ezaugarriak ditu. Hortaz, ez du zentzu handirik metalak eta haien konposatuak talde berean sartzeak.
Hori dela eta, IUPACen aditu-batzordearen arabera, metal astunen kontzeptua baztertzea komeniko litzateke, ez baitu oinarri zientifikorik. Gainera, gaur egun, arestian aipatu bezala, metal astunen kontzeptua poluzioarekin eta toxikotasunarekin zerikusia izan dezakeen elementu- edo konposatu-taldearekin lotzen da maiz. Baina aditu-talde horrek ez du inolaz ere lotura zuzenik egiten dentsitatearen nahiz gainerako ezaugarri fisiko kimikoen (masa atomikoa, zenbaki atomikoa...) eta toxikotasunaren artean.

Beraz, ikuspuntu akademiko batetik behintzat, argi esan liteke metal astunen kontzeptua zaharkitua dagoela, eta baztertu egin beharko litzatekeela. Zaila izango da, ordea, ikuspuntu hori akademiatik gizartera hedatzea, eta, lortuta ere, arazoa legoke oraindik metal izendapenarekin. Izan ere, egun metal hitza erabiltzen da metalei nahiz haien konposatuei erreferentzia egiteko. Horrek esan nahi du metalak eta haien konposatuak ezaugarri fisiko-kimiko, biologiko eta toxikologiko berdinak balituzte bezala tratatzen direla, eta hori ez dela hala.
Justu kontrakoa gertatzen da karbonoaren kasuan. Alegia, ez da karbono izendapena erabiltzen karbonoaren konposatu guztiak adierazteko. Izan ere, hori hala balitz, karbonoa gizakiontzat kantzerigenotzat joko litzateke, haren zenbait konposatu minbizi- sortzaileak baitira. Beraz, metalak ere, karbonodun konposatuak bezala, bakoitza bere aldetik aztertu beharko lirateke.