Zorionak à vous, zorionak Henrietta?
En 2020, si spécial et exigeant pour tous, dans lequel le covid-19 a dirigé presque toutes les nouvelles, est resté hors des projecteurs (à notre discrétion) un anniversaire, le 100e anniversaire de la naissance d'Henrietta Lacks. Bien que la vie d'Henrietta ait été courte et simple, ses cellules aident non seulement à maîtriser le covid-19, mais aident à comprendre et analyser les causes d'autres maladies. Ces cellules sont devenues un instrument d'une importance vitale. C'est notre petit hommage.
En 2020, on fête les 100 ans de la naissance du bertsolari Xalbador, du saxophoniste Charlie Parker et du cinéaste Ray Harryhaus, entre autres. A côté de ces personnages célèbres, le centenaire de la naissance d'Henrietta Lacks, moins connu, a également été célébré. Malgré sa moindre réputation, Henrietta a eu une grande importance dans de nombreuses études biomédicales. Grâce à elle, un vaccin contre la poliomyélite a été créé et plusieurs découvertes ont été faites pour combattre le sida, la maladie de Parkinson, le papillomabirus humain, le cancer, etc. En fait, au moins une demi-douzaine de prix Nobel lui doivent en partie sa reconnaissance.
Mais comment est devenu un pilier fondamental dans la recherche de haut niveau ce tabac qui est mort à 31 ans?Henrietta, en 1951, s’approcha de l’hôpital John Hopkins de Baltimore et, à l’entrée de la clinique gynécologique, il dit «I got a pon in my womb» (j’ai un nœud dans l’utérus). Après l'exploration initiale, ils ont trouvé une masse dense sur le col utérin d'Henrietta, qui, comme d'habitude à l'époque, a obtenu un échantillon et l'ont emmenée au laboratoire de pathologie de l'hôpital pour un diagnostic plus profond. À cette époque, le laboratoire était dirigé par le mariage George-Otto Gey et Margaret Koudelka.
George, chercheur en cancer, avait constamment besoin de nouvelles cellules pour ses essais, car dans des conditions in vitro la plupart des cellules mouraient relativement rapidement (bien que Margaret était un expert dans le maintien des cellules et dans le maintien des conditions d'asepsie des laboratoires). Mais les cellules obtenues de la tumeur d'Henrietta, cependant, étaient divisées toutes les 24 heures et ne cessaient de se fragmenter. George a été fasciné et, comme d'habitude, a nommé ces cellules nouvellement obtenues en combinant le nom et prénom du patient comme cellules HeLa. Pendant ce temps, Henrietta mourut 10 mois après sa première visite à l'hôpital, tandis que ses cellules cancéreuses continuaient à se fragmenter dans les laboratoires.
Quand il a découvert qu'il avait entre ses mains un outil avec un grand potentiel, George a commencé à distribuer des cellules largement et librement aux laboratoires américains. Il est à noter que George a également livré des échantillons de cellules HeLa à divers laboratoires avant d'effectuer des recherches avec des cellules HeLa. George Gey était plus un chercheur ou un entrepreneur que professeur et a traité les cellules d'Henrietta comme cadeau scientifique.
Bien que le voyage le plus long réalisé par Henrietta au cours de sa vie ait été le milieu entre Clover (Virginie) et Baltimore (Maryland), environ 400 kilomètres, ses cellules ont atteint tous les coins du monde, ont parcouru des milliers de kilomètres par laboratoire. Ils arrivent dans l'espace ! Aussi bien en MIR que dans la Station Spatiale Internationale.
En marge des kilomètres, l'argent a aussi beaucoup à dire dans cette histoire. Sur le site de l’ATCC (American Type Culture Collection), par exemple, lorsque des cellules comme «HeLa (ATCC® CCL-2TM)» sont demandées, le tube cellulaire coûte 595€ + transport. Les cellules Henrietta, depuis 1954, ont généré des millions et des millions d'euros pour les entreprises pharmaceutiques, ce qui a permis des progrès médicaux spectaculaires. Cependant, ni Henrietta ni ses 5 enfants n'ont eu une assurance médicale. Comme mentionné ci-dessus, Henrietta a signé le formulaire de traitement conventionnel, mais il n'a pas reçu le consentement écrit pour l'obtention d'échantillons de biopsie et n'a jamais été expliqué ce qui a été fait avec ses cellules cancéreuses. La procédure de 1951 a été suivie et le fait d'être une femme et un noir de peau ne l'a pas aidé à garantir ses droits.
Ces cellules, en plus d'être dispersées dans tous les laboratoires du monde, sont capables de contaminer d'autres cultures cellulaires. Dans les années 1960-70, et en supposant que plusieurs chercheurs travaillaient avec d'autres types de cellules, ils ont réalisé que dans leurs récipients d'élevage ils avaient des cellules HeLa ! Les cellules de Henrietta avaient une grande capacité de fragmentation, ce qui permettait le remplacement des cellules originales de l'emballage. Cela a suscité l'intérêt des chercheurs pour les cellules HeLa, qui ont commencé à se demander de leur origine. Qui était donc le malade qui était derrière le nom de “HeLa”? Au début, le laboratoire du mariage Gey, dans le but de cacher son nom original, a donné d'autres pseudonymes (Helen Lane ou Helen Larsen) à des chercheurs et journalistes qui cherchaient son origine. Cependant, le secret n'a pas pu être maintenu. Cependant, les parents d'Henrietta ont dû attendre davantage pour le connaître et plus encore pour comprendre l'importance de la découverte.
Actuellement, lorsque les tissus d'un patient sont acquis pour la recherche, il est nécessaire que le malade donne son consentement écrit. Une fois l'échantillon obtenu devient anonyme et le donneur, le patient, n'est pas propriétaire de l'échantillon. Autrement dit, le malade n'a pas de droits futurs sur les revenus qui peuvent découler de ces tissus.
Cette situation a cependant considérablement changé en 2013. G3: Dans la revue Genes, Genomes, Genetics a publié la caractérisation génomique d'une souche à cellules HeLa (Landry et al., 2013) et tout le génome en ligne a été mis à disposition. C'est très intéressant pour les chercheurs, mais il a beaucoup d'incidences éthiques. Bien que les cellules de HeLa aient beaucoup changé après 62 ans, les informations génétiques d'Henrietta et de sa famille ont été publiquement disponibles. Après avoir éliminé la séquence génomique d'une base de données bien connue, le Laboratoire européen de biologie moléculaire (EMBL), l'Institut national de santé des États-Unis (NIH) et la famille Lacks ont conclu un accord sur l'utilisation des cellules HeLa.
Malheureusement, la famille Lacks n'est pas le seul cas, il existe actuellement des milliers de lignes cellulaires et les progrès en séquençage et en bioinformatique permettent de remettre en question l'anonymat des donateurs. Il est donc de plus en plus nécessaire de favoriser les relations entre donateurs, chercheurs et institutions.
Transformation cellulaire de la henrietta
Les cellules tumorales de henrietta ont leur origine dans un papilomavirus humain (HPV). La cellule intériorise ces virus par des processus cellulaires d'endocytose et par la suite l'ADN viral est intégré dans l'ADN de la cellule hôte. Dans le cas de la henrietta, cette injection d'ADN virale a eu lieu près du gène c-myc. Être C-myc l'un des gènes les plus importants qui pousse la division cellulaire, permet d'exprimer HeLa en permanence (continue) dans les cellules, de sorte que la division cellulaire est constamment stimulée. D'autre part, HeLa est la haute activité de la télomérose dans les cellules. Les télomères sont les extrémités des chromosomes stabilisés par la toile de fond. Quand des divisions de cellules se produisent, les télomères se raccourcissent et, quand une taille critique est atteinte, ils cessent de diviser les cellules ou ont plus de difficultés à les diviser. Pour l'étirement des télomères, l'activité de l'enzyme télomérase est nécessaire, donc dans le cas des cellules HeLa, malgré de nombreuses divisions, les télomères sont suffisamment longs pour pouvoir continuer à produire la division cellulaire.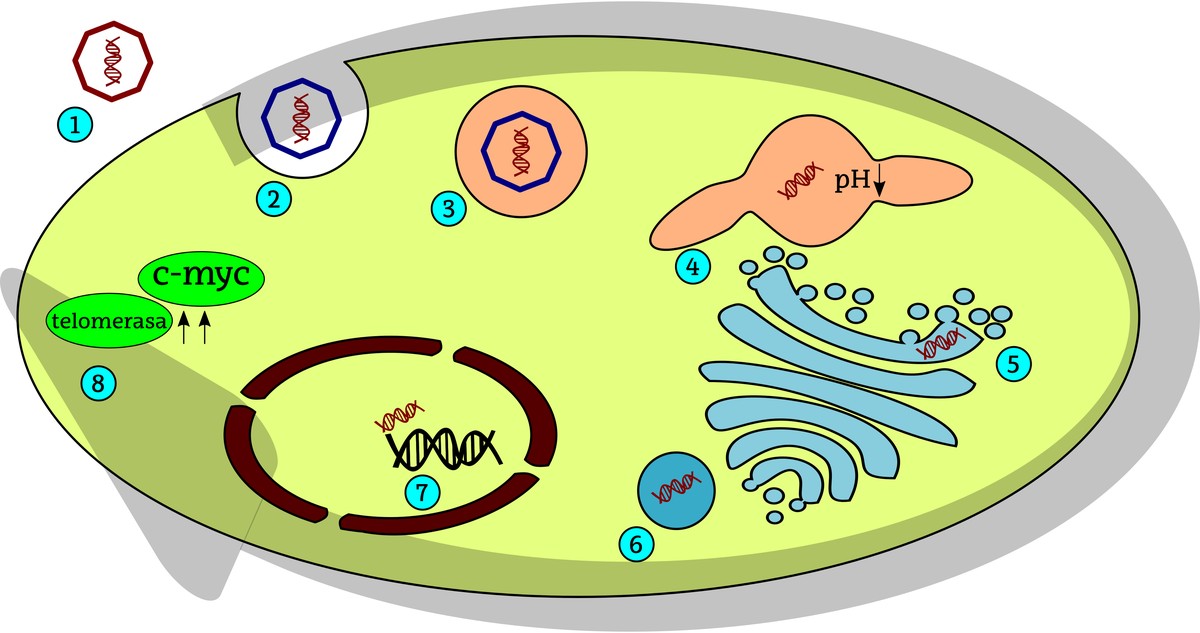
Henrietta est née il y a 100 ans et est décédée il y a 69 mois, mais ses cellules sont encore vivantes dans des laboratoires du monde entier. Les cellules de HeLa ne répondent pas aux questions personnelles que Deborah, la fille d'Henrietta, a sur sa mère (quelle était la couleur préférée de sa mère ? Aimez-vous danser? ), mais ils aideront à résoudre d'autres questions scientifiques. On sait si ses cellules continueront à célébrer pour toujours.
Merci pour votre contribution à la science et félicitations à Henrietta!
Lecture supplémentaire:
Landry JJ, Pyl PT, Rausch T, Zichner T, Tekkedil MM, Stütz AM, Jauch A, Aiyar RS, Pau G, Delhomme N, Gagneur J, Korbel JO, Huber Lw. 2013 "The genomic and transcriptomic landscape of a HeLa cell line". G3: Gènes, Génomes, Genetics. 3 (8): 24-1213.






