Zorionak a ti, zorionak Henrietta?
En el año 2020, tan especial y exigente para todos, en el que el covid-19 ha liderado casi todas las noticias, ha quedado fuera de los focos (bajo nuestro criterio) un aniversario, el 100 aniversario del nacimiento de Henrietta Lacks. Aunque la vida de Henrietta fue corta y sencilla, sus células no sólo ayudan a dominar el covid-19, sino que ayudan a comprender y analizar las causas de otras enfermedades. Estas células se han convertido en un instrumento de vital importancia. Este es nuestro pequeño homenaje.
En el año 2020 se cumplen 100 años del nacimiento del bertsolari Xalbador, del saxofonista Charlie Parker y del cineasta Ray Harryhaus, entre otros. Junto a estos famosos personajes, se ha cumplido también el centenario del nacimiento de Henrietta Lacks, menos conocido. A pesar de su menor fama, Henrietta ha tenido una gran importancia en numerosos estudios biomédicos. Gracias a ella, se creó una vacuna contra la poliomielitis y se han realizado varios descubrimientos para combatir el sida, la enfermedad de Parkinson, el papilomabirus humano, el cáncer, etc. De hecho, al menos media docena de premios Nobel le deben en parte su reconocimiento.
Pero, ¿cómo ha llegado a ser un pilar fundamental en la investigación de alto nivel este tabaquero que murió a los 31 años?Henrietta, en 1951, se acercó al hospital John Hopkins de Baltimore y a la entrada de la clínica ginecológica dijo “I got a k> in my womb” (tengo un nudo en el utero). Tras la exploración inicial, encontraron una masa densa en el cuello uterino de Henrietta, de la que, como era habitual en la época, obtuvieron una muestra y la llevaron al laboratorio de patología del hospital para realizar un diagnóstico más profundo. En aquella época, el laboratorio estaba dirigido por el matrimonio George-Otto Gey y Margaret Koudelka.
George, investigador del cáncer, necesitaba constantemente nuevas células para sus ensayos, ya que en condiciones in vitro la mayoría de las células murían relativamente rápido (aunque Margaret era un experto en el mantenimiento de las células y en el mantenimiento de las condiciones de asepsia de los laboratorios). Pero las células obtenidas del tumor de Henrietta, sin embargo, se dividían cada 24 horas y no dejaban de fragmentarse. George quedó fascinado y, como era habitual, nombró a estas células recién obtenidas combinando el nombre y apellidos del paciente como células HeLa. Mientras tanto, Henrietta murió 10 meses después de su primera visita al hospital, mientras sus células cancerosas seguían fragmentándose en los laboratorios.
Cuando descubrió que tenía entre sus manos una herramienta con un gran potencial, George comenzó a distribuir células de forma amplia y libre a los laboratorios de Estados Unidos. Es de destacar que George también entregó muestras de células HeLa a diversos laboratorios antes de realizar investigaciones con células HeLa. George Gey era más investigador o empresario que profesor y trató las células de Henrietta como regalo científico.
A pesar de que el viaje más largo que realizó Henrietta durante su vida fue el medio entre Clover (Virginia) y Baltimore (Maryland), unos 400 kilómetros, sus células han llegado a todos los rincones del mundo, han viajado miles de kilómetros por laboratorio. ¡Llegan al espacio! Tanto en MIR como en la Estación Espacial Internacional.
Al margen de los kilómetros, el dinero también tiene mucho que decir en esta historia. En la página web del ATCC (American Type Culture Collection), por ejemplo, cuando se solicitan células como “HeLa (ATCC® CCL-2TM)”, el tubo celular tiene un coste de 595€ + transporte. Las células de Henrietta, desde 1954, han generado millones y millones de euros para las empresas farmacéuticas, lo que ha permitido avances médicos espectaculares. Sin embargo, ni Henrietta ni sus 5 hijos tuvieron seguro médico. Como se ha mencionado anteriormente, Henrietta firmó el impreso de tratamiento convencional, pero no se le dio el consentimiento escrito para la obtención de muestras de biopsia y nunca se le explicó qué se hizo con sus células cancerígenas. Se siguió el procedimiento del año 1951 y el hecho de ser mujer y negro de piel no le ayudó a garantizar sus derechos.
Estas células, además de estar dispersas por todos los laboratorios del mundo, son capaces de contaminar otros cultivos celulares. En los años 1960-70, y suponiendo que varios investigadores estaban trabajando con otros tipos de células, ¡se dieron cuenta de que en sus envases de cría tenían células HeLa! Las células de Henrietta tenían una gran capacidad de fragmentación, lo que permitía la sustitución de las células originales del envase. Esto despertó el interés de los investigadores por las células de HeLa, que comenzaron a preguntarse por su origen. ¿Quién era, por tanto, el enfermo que estaba detrás del nombre de “HeLa”? En un principio, el laboratorio del matrimonio Gey, con el objetivo de ocultar su nombre original, le dieron otros seudónimos (Helen Lane o Helen Larsen) a investigadores y periodistas que buscaban su origen. Sin embargo, el secreto no pudo mantenerse. Sin embargo, los familiares de Henrietta tuvieron que esperar aún más para conocerlo y más para comprender la importancia del descubrimiento.
En la actualidad, cuando los tejidos de un paciente se adquieren para la investigación, es necesario que el enfermo dé su consentimiento escrito. Una vez obtenida la muestra pasa a ser anónima y el donante, el paciente, no es propietario de la muestra. Es decir, el enfermo no tiene derechos futuros sobre los ingresos que puedan derivarse de esos tejidos.
Esta situación, sin embargo, cambió notablemente en 2013. G3: En la revista Genes, Genomes, Genetics se publicó la caracterización genómica de una cepa de células HeLa (Landry et al., 2013) y se puso a disposición todo el genoma online. Esto es muy interesante para los investigadores, pero tiene muchas incidencias éticas. A pesar de que las células de HeLa han mutado mucho después de 62 años, la información genética de Henrietta y sus familiares quedó públicamente disponible. Tras eliminar la secuencia genómica de una conocida base de datos, el Laboratorio Europeo de Biología Molecular (EMBL), el Instituto Nacional de Salud de Estados Unidos (NIH) y la familia Lacks llegaron a un acuerdo sobre el uso de células HeLa.
Desgraciadamente, la familia Lacks no es el único caso, en la actualidad existen miles de líneas celulares y los avances en secuenciación y bioinformática permiten cuestionar el anonimato de los donantes. Por tanto, es cada vez más necesario fomentar las relaciones entre donantes, investigadores e instituciones.
Transformación celular de la henrietta
Las células tumorales de la henrietta tienen su origen en un papilomavirus humano (HPV). La célula interioriza estos virus mediante procesos celulares de endocitosis y posteriormente el ADN vírico se integra en el ADN de la célula huésped. En el caso de la henrietta, esta inyección de ADN vírico tuvo lugar cerca del gen c-myc. Siendo C-myc uno de los genes más importantes que impulsa la división celular, permite expresar HeLa de forma constante (continua) en las células, por lo que la división celular se impulsa constantemente. Por otro lado, HeLa es la alta actividad de la telomerosis en las células. Los telómeros son los extremos de los cromosomas estabilizados por telomasas. Cuando se producen divisiones de células, los telómeros se van acortando y, cuando se alcanza un tamaño crítico, dejan de dividir las células o tienen más dificultades para dividirlas. Para la estiramiento de los telómeros es necesaria la actividad de la enzima telomerasa, por lo que en el caso de las células de HeLa, a pesar de haber realizado numerosas divisiones, los telómeros son lo suficientemente largos para poder seguir produciendo la división celular.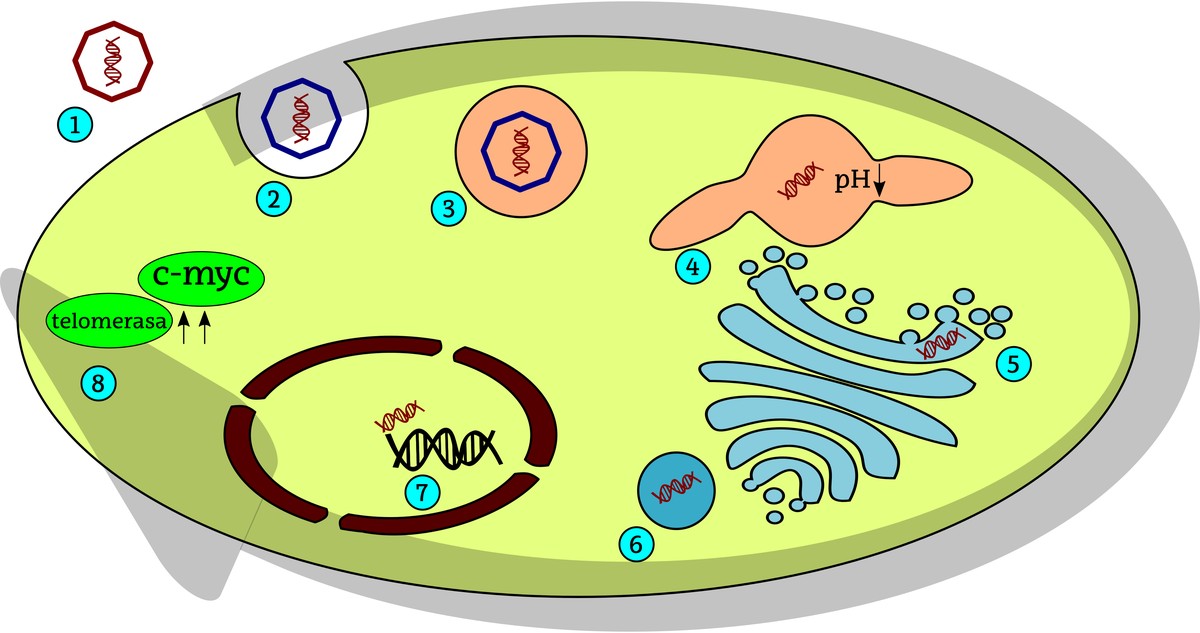
Henrietta nació hace 100 años y falleció hace 69 meses, pero sus células siguen vivas en laboratorios de todo el mundo. Las células de HeLa no responden a las preguntas personales que Deborah, la hija de Henrietta, tiene sobre su madre (¿cuál era el color favorito de su madre? ¿Le gustaba bailar? ), pero ayudarán a resolver otras cuestiones científicas. Uno sabe si sus células seguirán celebrando para siempre.
Gracias por su aportación a la ciencia y enhorabuena a Henrietta!
Lectura adicional:
Landry JJ, Pyl PT, Rausch T, Zichner T, Tekkedil MM, Stütz AM, Jauch A, Aiyar RS, Pau G, Delhomme N, Gagneur J, Korbel JO, Huber Lw. 2013 "The genomic and transcriptomic landscape of a HeLa cell line". G3: Genes, Genomes, Genetics. 3 (8): 24-1213.






