Nanomedicina como tratamento do cancro de mama
O cancro de mama é a enfermidade que máis morte provoca nas mulleres. As terapias que se utilizan actualmente paira combater o cancro son principalmente a quimioterapia e a radioterapia [1, 2], e son técnicas altamente invasoras que provocan numerosos efectos indesexables [3]. A quimioterapia convencional afecta a todo o organismo, danando tanto as células cancerosas como as sas. Por iso, limítase a dose de quimioterapia ao tratarse dun tratamento moi tóxico. As nanopartículas poden ser recursos terapéuticos adecuados paira superar esta falta de especificidad da quimioterapia convencional [4].
Así, mediante nanopartículas, é posible liberar o fármaco contra o cancro no lugar de aplicación ou concentralo na tecido diana reducindo a toxicidade sistémica. Ademais, solucionan os problemas dalgúns fármacos como a baixa solubilidad ou a inestabilidade química. Ademais, mellórase a farmacocinética dos fármacos e redúcense as resistencias dos fármacos utilizados na quimioterapia [5]. Como consecuencia de todo iso, as nanotecnoloxías desenvolvidas paira o tratamento do cancro de mama conseguiron una maior eficacia e supervivencia en pacientes con cancro de mama e una redución dos efectos non desexados da quimioterapia.
Características e mecanismos de accionamiento das nanopartículas
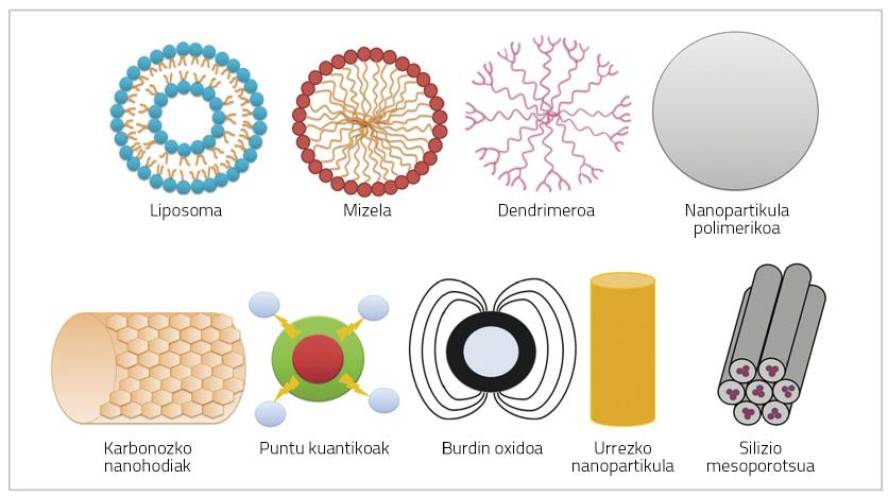
As nanopartículas son partículas de moi pequeno tamaño (< 100 nm) que poden estar formadas por polímeros, lípidos, virus ou compostos organometálicos (Figura 1) [6].
Para que os medicamentos utilizados no tratamento do cancro de mama sexan plenamente efectivos é necesario ter en conta dous factores. Por unha banda, chegar ao tecido no que se atopa o tumor a maior dose posible de medicamentos, e por outro, que o medicamento que chega ao tecido afecte directamente ás células cancerosas. Ambas as accións poden producirse mediante enrutamientos pasivos ou activos por nanopartículas (Figura 2) [4].
Encaminamiento pasivo
O fármaco adminístrase de forma inactiva e ao chegar ao tecido tumoral se metaboliza, actívase e convértese nun fármaco moi tóxico [7, 8, 9]. O encaminamiento pasivo pódese realizar de tres formas:
a) Aumento da permeabilidade dos vasos sanguíneos e efecto de retención (EPR)
A medida que aumentan as células tumorales e os tecidos tumorales, aumenta a súa necesidade de osíxeno e nutrientes. Paira satisfacer estas necesidades de osíxeno e nutrientes créase un novo sistema de capilares sanguíneos que non se desenvolve completamente e que, por tanto, é máis permeable paira certas partículas de certo tamaño. É por iso que as nanopartículas adoitan acumularse en células tumorales, o que permite aumentar a dose de medicamento que influirá no interior das células cancerosas sen causar toxicidade en células sas [4, 8].
b) Microambiente tumoral
Esta estratexia considera a contorna do tumor. O fármaco adminístrase ao paciente conxugado (de forma inactiva) cunha molécula específica do tumor e, ao chegar ao mesmo, o contorno do tumor convérteo nunha sustancia activa [10].
c) Administración in situ
A aplicación directa do fármaco quimioterapéutico no tumor evita a toxicidade sistémica e permite reducir a dose do fármaco. Por exemplo, a administración de C mitomicina - dextrano conxugado no interior do tumor permitiu detectar una maior concentración do fármaco anticanal na zona do tumor e una diminución da toxicidade sistémica [8].
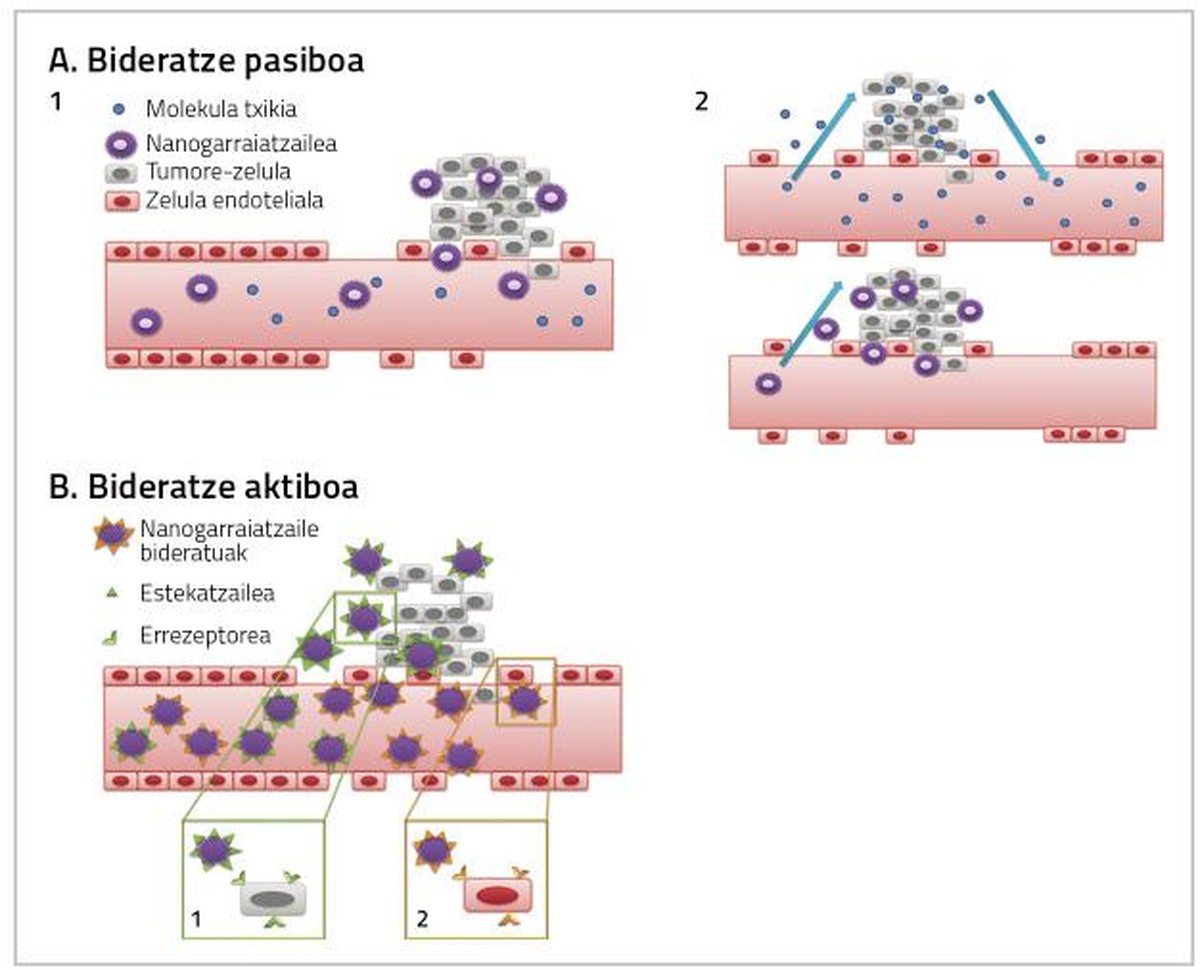
Enrutamiento activo
O propósito do enrutamiento activo consiste en interaccionar as nanopartículas conxugadas coa diana da área obxecto do tratamento, de forma que o tecido cancerígeno alcance una maior dose de fármaco (Figura 2).
As células cancerosas presentan características similares aos tecidos sans. Por iso, paira a separación destas células utilízanse ligantes específicos aos receptores que se sobreexpresan nas células cancerosas, xerando interaccións específicas. Algúns exemplos son a asociación de carbohidratos de lectina, receptores de ligantes e anticorpos de antígenos [8, 9, 11].
a) Orientación a carbohidratos
Uno dos exemplos máis importantes é o do carbohidrato de lectina. Os carbohidratos que se atopan na superficie das células tumorales non son como os das células normais. A lectina é capaz de recoñecer as glicoproteínas presentes na superficie celular e asocialas a elas. En consecuencia, algúns hidratos de carbono interactúan con lectinas, creando enlaces celulares específicos. As lectinas, por tanto, poden ser moléculas paira transferir o fármaco ás células ou tecidos aos que se dirixe. A través desta asociación de carbohidratos de lectina pódense desenvolver dúas nanopartículas diferentes. Por unha banda, as lectinas poden ir integradas en nanopartículas e interaccionan cos carbohidratos presentes na superficie das células obxectivo. É o que se coñece como condución directa de lectinas. Doutra banda, os hidratos de carbono están integrados en nanopartículas paira interactuar coas lectinas presentes nas células obxectivo. Isto é o que se denomina escalado inverso de lectinas [4].
b) Condución de receptores
O fármaco conxúgase cun transportador polimérico que se une ás células grazas a un ligante que leva na estrutura [12]. Un exemplo é o receptor de folatos. Cando un conxugado destinado aos folatos na superficie celular únese aos receptores de folatos, a membrana plasmática recolle este conxugado do receptor e o ligante formando un endosoma. O pH endosómico acidifícase e a medida que as lisozimas actívanse, o fármaco vaise liberando do conxugado e introdúcese no citoplasma. Mentres tanto, o receptor de folato liberado volve á membrana plasmática paira reiniciar o proceso [4].
d) Tramitación de anticorpos
Esta estratexia baséase na acción de anticorpos monoclonales paira orientar as nanopartículas cara ao tecido tumoral [12]. Exemplo diso son os inmunoliposomas. Os liposomas conxugados con anticorpos forman un enlace específico co antígeno superficial das células diana, mediante o cal o fármaco anticanceríxeno chega ao tecido tumoral (Figura 2) [13].
Reflexións finais
Á vista destas posibilidades, pódese prever a eficacia destes nanomedicina. Con todo, son poucos os nanomedicina postos no mercado e aínda moitos dos existentes paira a súa comercialización atópanse en ensaios clínicos ou en fases preclínicas. A pesar de que isto supón moito tempo e moito financiamento, os beneficios que poden reportar as nanopartículas fan necesario ter en conta a súa importancia. Por iso, será necesario realizar máis investigacións e desenvolver novas nanopartículas, xa que ademais de dar grandes avances na tecnoloxía farmacéutica e na saúde, poden reportar un enorme beneficio á sociedade.





