Nanomedicina com a tractament del càncer de mama
El càncer de mama és la malaltia que més mort provoca en les dones. Les teràpies que s'utilitzen actualment per a combatre el càncer són principalment la quimioteràpia i la radioteràpia [1, 2], i són tècniques altament invasores que provoquen nombrosos efectes indesitjables [3]. La quimioteràpia convencional afecta a tot l'organisme, danyant tant les cèl·lules canceroses com les sanes. Per això, es limita la dosi de quimioteràpia en tractar-se d'un tractament molt tòxic. Les nanopartícules poden ser recursos terapèutics adequats per a superar aquesta falta d'especificitat de la quimioteràpia convencional [4].
Així, mitjançant nanopartícules, és possible alliberar el fàrmac contra el càncer en el lloc d'aplicació o concentrar-lo en el teixit diana reduint la toxicitat sistèmica. A més, solucionen els problemes d'alguns fàrmacs com la baixa solubilitat o la inestabilitat química. A més, es millora la farmacocinètica dels fàrmacs i es redueixen les resistències dels fàrmacs utilitzats en la quimioteràpia [5]. Com a conseqüència de tot això, les nanotecnologies desenvolupades per al tractament del càncer de mama han aconseguit una major eficàcia i supervivència en pacients amb càncer de mama i una reducció dels efectes no desitjats de la quimioteràpia.
Característiques i mecanismes d'accionament de les nanopartícules
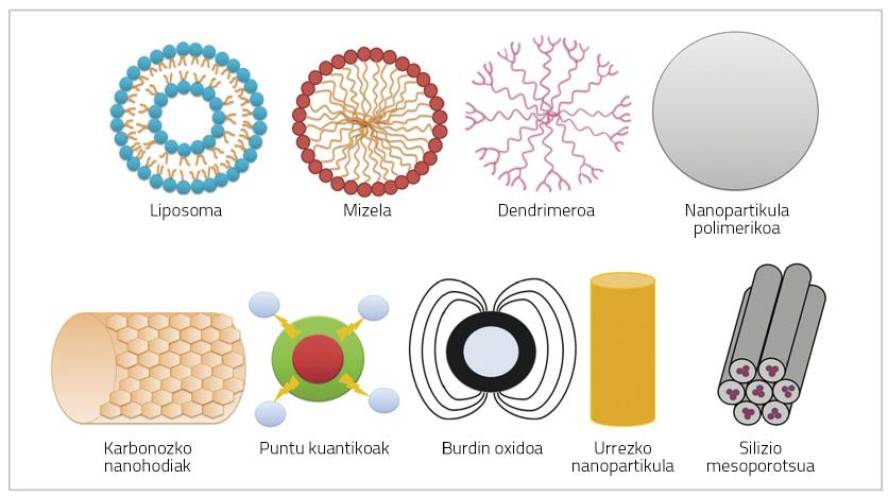
Les nanopartícules són partícules de molt petita grandària (< 100 nm) que poden estar formades per polímers, lípids, virus o compostos organometálicos (Figura 1) [6].
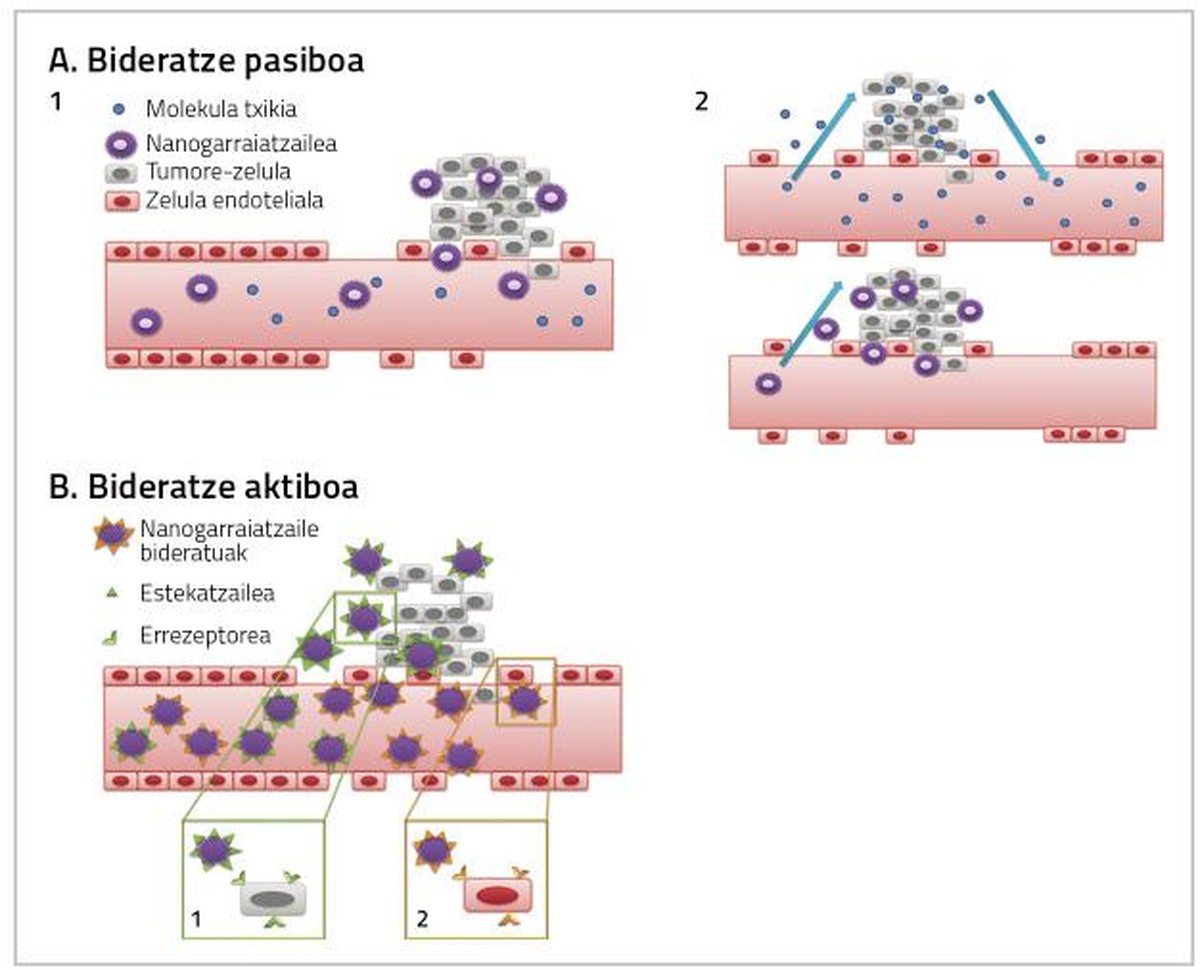
Perquè els medicaments utilitzats en el tractament del càncer de mama siguin plenament efectius és necessari tenir en compte dos factors. D'una banda, arribar al teixit en el qual es troba el tumor la major dosi possible de medicaments, i per un altre, que el medicament que arriba al teixit afecti directament les cèl·lules canceroses. Totes dues accions poden produir-se mitjançant encaminaments passius o actius per nanopartícules (Figura 2) [4].
Encaminament passiu
El fàrmac s'administra de manera inactiva i en arribar al teixit tumoral es metaboliza, s'activa i es converteix en un fàrmac molt tòxic [7, 8, 9]. L'encaminament passiu es pot realitzar de tres formes:
a) Augment de la permeabilitat dels vasos sanguinis i efecte de retenció (EPR)
A mesura que augmenten les cèl·lules tumorals i els teixits tumorals, augmenta la seva necessitat d'oxigen i nutrients. Per a satisfer aquestes necessitats d'oxigen i nutrients es crea un nou sistema de capil·lars sanguinis que no es desenvolupa completament i que, per tant, és més permeable per a certes partícules de certa grandària. És per això que les nanopartícules solen acumular-se en cèl·lules tumorals, la qual cosa permet augmentar la dosi de medicament que influirà a l'interior de les cèl·lules canceroses sense causar toxicitat en cèl·lules sanes [4, 8].
b) Microambiente tumoral
Aquesta estratègia considera l'entorn del tumor. El fàrmac s'administra al pacient conjugat (de manera inactiva) amb una molècula específica del tumor i, en arribar a aquest, el contorn del tumor el converteix en una substància activa [10].
c) Administració in situ
L'aplicació directa del fàrmac quimioterapéutico en el tumor evita la toxicitat sistèmica i permet reduir la dosi del fàrmac. Per exemple, l'administració de C mitomicina - dextrano conjugat a l'interior del tumor va permetre detectar una major concentració del fàrmac anticanal en la zona del tumor i una disminució de la toxicitat sistèmica [8].
Encaminament actiu
El propòsit de l'encaminament actiu consisteix a interaccionar les nanopartícules conjugades amb les diana de l'àrea objecte del tractament, de manera que el teixit cancerigen abast una major dosi de fàrmac (Figura 2).
Les cèl·lules canceroses presenten característiques similars als teixits sans. Per això, per a la separació d'aquestes cèl·lules s'utilitzen ligantes específics als receptors que se sobreexpresan en les cèl·lules canceroses, generant interaccions específiques. Alguns exemples són l'associació de carbohidrats de lectina, receptors de ligantes i anticossos d'antígens [8, 9, 11].
a) Orientació a carbohidrats
Un dels exemples més importants és el del carbohidrat de lectina. Els carbohidrats que es troben en la superfície de les cèl·lules tumorals no són com els de les cèl·lules normals. La lectina és capaç de reconèixer les glicoproteïnes presents en la superfície cel·lular i associar-les a elles. En conseqüència, alguns hidrats de carboni interactuen amb lectines, creant enllaços cel·lulars específics. Les lectines, per tant, poden ser molècules per a transferir el fàrmac a les cèl·lules o teixits als quals es dirigeix. A través d'aquesta associació de carbohidrats de lectina es poden desenvolupar dues nanopartícules diferents. D'una banda, les lectines poden anar integrades en nanopartícules i interaccionen amb els carbohidrats presents en la superfície de les cèl·lules objectiu. És el que es coneix com a conducció directa de lectines. D'altra banda, els hidrats de carboni estan integrats en nanopartícules per a interactuar amb les lectines presents en les cèl·lules objectiu. Això és el que es denomina escalat invers de lectines [4].
b) Conducció de receptors
El fàrmac es conjuga amb un transportador polimèric que s'uneix a les cèl·lules gràcies a un ligante que porta en l'estructura [12]. Un exemple és el receptor de folatos. Quan un conjugat destinat als folatos en la superfície cel·lular s'uneix als receptors de folatos, la membrana plasmàtica recull aquest conjugat del receptor i el ligante formant un endosoma. El pH endosómico s'acidifica i a mesura que les lisozimas s'activen, el fàrmac es va alliberant del conjugat i s'introdueix en el citoplasma. Mentrestant, el receptor de folato alliberat torna a la membrana plasmàtica per a reiniciar el procés [4].
d) Tramitació d'anticossos
Aquesta estratègia es basa en l'acció d'anticossos monoclonals per a orientar les nanopartícules cap al teixit tumoral [12]. Exemple d'això són els inmunoliposomas. Els liposomes conjugats amb anticossos formen un enllaç específic amb l'antigen superficial de les cèl·lules diana, mitjançant el qual el fàrmac anticancerígeno arriba al teixit tumoral (Figura 2) [13].
Reflexions finals
A la vista d'aquestes possibilitats, es pot preveure l'eficàcia d'aquests nanomedicina. No obstant això, són pocs els nanomedicina llocs en el mercat i encara molts dels existents per a la seva comercialització es troben en assajos clínics o en fases preclínicas. A pesar que això suposa molt temps i molt de finançament, els beneficis que poden reportar les nanopartícules fan necessari tenir en compte la seva importància. Per això, serà necessari realitzar més recerques i desenvolupar noves nanopartícules, ja que a més de donar grans avanços en la tecnologia farmacèutica i en la salut, poden reportar un enorme benefici a la societat.





