Farmacogenética, base do medicamento personalizado
EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; Farmakologia
Medikamenduen Garapen, Balioztatze eta Erabilera Arrazionala masterreko ikaslea; EHUko Farmakologia Saila eta Centro de Investigación Biomédica en Red de Salud Mental, CIBERSAM
EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; Farmakologia
Medikamenduen Garapen, Balioztatze eta Erabilera Arrazionala masterreko ikaslea; EHUko Farmakologia Saila eta Centro de Investigación Biomédica en Red de Salud Mental, CIBERSAM
Askaiturrieta Ostolaza, Ziortza
EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; Farmakologia
Medikamenduen Garapen, Balioztatze eta Erabilera Arrazionala masterreko ikaslea; EHUko Farmakologia Saila eta Centro de Investigación Biomédica en Red de Salud Mental, CIBERSAM
EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; Farmakologia
Medikamenduen Garapen, Balioztatze eta Erabilera Arrazionala masterreko ikaslea; EHUko Farmakologia Saila eta Centro de Investigación Biomédica en Red de Salud Mental, CIBERSAM
Pensaches algunha vez por que o café non afecta igual a todas as persoas? Algúns non poden tomar o café a partir de una hora, porque o manteñen durante moito tempo no corpo, e logo non poden durmir. A miúdo escoitamos frases como "una aspirina non me fai nada", "o ibuprofeno vénme mellor" ou "Teño que tomar un ibuprofeno de 600 mg paira notar o efecto". Ademais, é habitual que o médico cambie a dose do fármaco e aconselle a súa devolución a semana seguinte. Isto significa que cada individuo responde de forma diferente aos fármacos e que necesitamos doses diferentes.
Farmacogenética
É sabido que moitos fármacos non son eficaces nunha parte da poboación, e leste é un dos retos que se está dando na actualidade en medicamento. Por exemplo, os fármacos antihipertensivos moi utilizados, como os betabloqueantes, son parcialmente eficaces ou ineficaces no 70% dos pacientes. A administración a pacientes non afectados por estes fármacos é prexudicial (polos seus efectos secundarios) e inútil, tanto en termos de efecto como económicos. Con todo, non hai probas que permitan predicir quen responde tras a administración do fármaco, polo que os clínicos seguen utilizando aproximacións proba-erro.
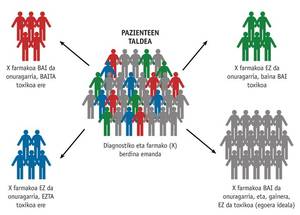
O obxectivo principal da farmacogenética é optimizar o tratamento individual e lograr una terapia personalizada eficaz e segura, determinando a influencia da xenética de cada persoa na resposta dos fármacos. Este coñecemento pode cambiar a forma de recetar fármacos na práctica clínica diaria. A farmacogenética permite realizar una preselección dos pacientes que respondan a un tratamento e da dose máis adecuada dos mesmos. É dicir, permitirá seleccionar o fármaco adecuado á dose adecuada paira o paciente ao que pertence (Figura 1). Desta forma pódese evitar o uso innecesario e os efectos secundarios dos medicamentos.
A xenética: fonte da diversidade
Do mesmo xeito que ocorre co café, no caso dos fármacos, clasificamos aos individuos en tres grupos: metabolizadores rápidos, que eliminan sustancias a gran velocidade; metabolizadores comúns, que as expulsan a unha velocidade adecuada; e metabolizadores lentos, que eliminan algunhas sustancias de forma ineficiente. Neste último caso, as sustancias permanecen máis tempo do necesario no corpo. No caso do café, isto provoca a incapacidade de durmir, mentres que no caso dos fármacos pode provocar efectos tóxicos. No ser humano encárganse de metabolizar o café e moitos fármacos. Entre estas encimas, as familias CYP2 e CYP3 teñen especial importancia á hora de metabolizar os fármacos. Estas dúas familias de encimas presentan pequenas variacións dun individuo a outro. Estas variacións poden ser debidas a pequenas variacións na secuencia génica (SNP, polimorfismos mononucleótidos) ou á duplicación ou perda de xenes enteiros (CNV, variacións no número de copias). Estas variacións poden dar lugar á formación de diferentes proteínas ou á modificación da cantidade de proteínas. Como consecuencia, a efectividade do metabolismo dos fármacos varía e o seu efecto dura máis ou menos tempo. Noutras palabras, as diferenzas individuais que se producen na actividade do citocromo P450 serán as responsables da eficacia e seguridade dun fármaco. Isto depende en parte da cantidade de fármaco presente no sangue. Os Citocromo P450 ademais do café, metabolizan os fármacos utilizados en cancro, enfermidades psiquiátricas, etc. Actualmente existen chips comerciais que nos permiten coñecer a secuencia CYP de cada individuo e determinar o tipo de metabolizador.
Un chip de ADN baséase nunha superficie sólida (vidro, plástico, silicio) con micropozos. En cada pozo, a través dos dispensores automáticos, sitúase a coñecida secuencia de ADN. No caso das investigacións farmacogenéticas, nestes pozos establécense secuencias de ADN que poden ter individuos e que afectan á resposta dos fármacos. Paira a análise do ADN dun individuo basta cunha mostra de tecido (sangue ou saliva). Una vez obtida a mostra, rompen as células e extráese o ADN do núcleo. Posteriormente, este ADN márcase con moléculas fluorescentes e colócase en pozos. Pero só se pegará en pozos coa mesma secuencia. Entón, estes pozos emitirán brillo e, dado que a secuencia correspondente a cada pozo é coñecida, poderemos coñecer tamén a secuencia individual.
Variabilidade da resposta
Ademais destes xenes, existen xenes relacionados coa velocidade de absorción e eliminación (farmacocinética), así como coa resposta dun fármaco ás diferentes partes do corpo (farmacodinámica). Por iso, as diferentes respostas aos fármacos poden ser causadas por catro feitos. Por unha banda, cambios nas secuencias génicas dos metabolizadores das encimas; por outro, cambios nos transportadores e receptores dos fármacos; e por último, cambios nas proteínas que teñen certa relación coa resposta do fármaco.
Éxito da farmacogenética
Un exemplo do éxito da terapia personalizada é o tratamento de Trastuzumab en cancro de mama. No 20% dos cancros de mama que se diagnostican na actualidade, o xene HER2 ( epidermal growth factor receptor 2) está duplicado. Isto supón que o receptor dos factores de crecemento que codifica o xene estea superpuesto e aumente o número de receptores. Trastuzumab bloquea aos receptores e demostraron que só prolonga a súa supervivencia en pacientes con HER2 duplicado.
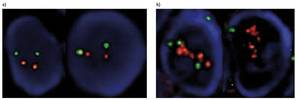
Existen diferentes métodos paira detectar pacientes con aumento de proteínas. Una delas é a hibridación fluorescente in situ (FISH), na que o xene se ve marcado fluorescentemente. Desta forma, en lugar de existir dúas copias do xene, pódense detectar casos nos que existen numerosas copias (figura 2). En pacientes que non teñen o xene HER2 duplicado, Trastuzumab non ten ningún beneficio, pero si un alto custo.
En canto á seguridade, sábese que un 15% dos pacientes sofren efectos secundarios derivados do fármaco. En pacientes con cancro colorrectal, por exemplo en pacientes con variante de xene UGT1A1, o fármaco Irinoteca se metaboliza mal. Como consecuencia diso, a administración de doses normais a estes pacientes levará a acumulación de Irinotecan no corpo e a neutropenia (diminución de neutrófilos). Os estudos farmacogenéticos permitiron determinar a dose adecuada. Unha análise do ADN permítenos coñecer nunhas poucas horas a variación do xene e determinar a dose adecuada.
Como se viu, a farmacogenética é fundamental paira identificar o fármaco eficaz paira o paciente e determinar a súa dose, evitando así os efectos secundarios. O que hai uns anos parecía un soño, hoxe en día é una realidade. A Asociación de Alimentos e Medicamentos de Estados Unidos (FDA) xa recomenda a inclusión de información farmacogenética na etiqueta dos envases dos fármacos. En concreto, na páxina web da FDA inclúese unha listaxe de 116 fármacos nos que se indican nos seus envases as accións específicas de información xenética a ter en conta. (http://www.fda.gov/Drugs/ScienceResearch/ResearchAreas/Pharmacogenetics/ucm083378.htm).
O noso equipo de investigación traballa na farmacogenética dos cancros infantís e en concreto na leucemia linfoblástica aguda (LLA). Nesta enfermidade trátase de localizar indicadores xenéticos que inflúen na toxicidade do metotrexato antineoplásico, uno dos fármacos máis importantes utilizados no tratamento destes nenos. De feito, este fármaco utilízase en altas doses, xa que a maioría dos nenos sopórtano ben e demostrouse que esta dura forma de administración aumenta a súa supervivencia. Con todo, a algúns nenos estas doses prodúcenlles efectos tóxicos moi graves até chegar a ser letais. Por iso, uno dos nosos obxectivos é atopar indicadores xenéticos que nos permitan predicir os efectos secundarios.
Bibliografía
Agradecemento
Os autores do presente traballo recibiron subvencións do Goberno Vasco (IT-199/07, SAIOTEK S-PE10UN14) e da Universidade do País Vasco (UFI 11/35). Grazas a Maialen Martin Arruti (Anatomía Patolóxica, Hospital Universitario Donostia).