Farmacogenética, base de la medicina personalitzada
EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; Farmakologia
Medikamenduen Garapen, Balioztatze eta Erabilera Arrazionala masterreko ikaslea; EHUko Farmakologia Saila eta Centro de Investigación Biomédica en Red de Salud Mental, CIBERSAM
EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; Farmakologia
Medikamenduen Garapen, Balioztatze eta Erabilera Arrazionala masterreko ikaslea; EHUko Farmakologia Saila eta Centro de Investigación Biomédica en Red de Salud Mental, CIBERSAM
Askaiturrieta Ostolaza, Ziortza
EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; Farmakologia
Medikamenduen Garapen, Balioztatze eta Erabilera Arrazionala masterreko ikaslea; EHUko Farmakologia Saila eta Centro de Investigación Biomédica en Red de Salud Mental, CIBERSAM
EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; EHUko Genetika, Antropologia Fisikoa eta Animalien Fisiologia Saila; Farmakologia
Medikamenduen Garapen, Balioztatze eta Erabilera Arrazionala masterreko ikaslea; EHUko Farmakologia Saila eta Centro de Investigación Biomédica en Red de Salud Mental, CIBERSAM
Has pensat alguna vegada per què el cafè no afecta igual a totes les persones? Alguns no poden prendre el cafè a partir d'una hora, perquè el mantenen durant molt de temps en el cos, i després no poden dormir. Sovint escoltem frases com "una aspirina no em fa res", "l'ibuprofeno em ve millor" o "Haig de prendre un ibuprofeno de 600 mg per a notar l'efecte". A més, és habitual que el metge canviï la dosi del fàrmac i aconselli la seva devolució la setmana següent. Això significa que cada individu respon de manera diferent als fàrmacs i que necessitem dosis diferents.
Farmacogenética
És sabut que molts fàrmacs no són eficaços en una part de la població, i aquest és un dels reptes que s'està donant en l'actualitat en medicina. Per exemple, els fàrmacs antihipertensivos molt utilitzats, com els betabloqueantes, són parcialment eficaços o ineficaços en el 70% dels pacients. L'administració a pacients no afectats per aquests fàrmacs és perjudicial (pels seus efectes secundaris) i inútil, tant en termes d'efecte com econòmics. No obstant això, no hi ha proves que permetin predir qui respon després de l'administració del fàrmac, per la qual cosa els clínics continuen utilitzant aproximacions proba-error.
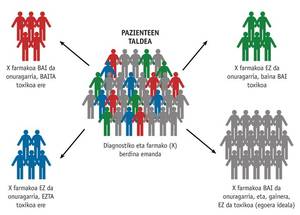
L'objectiu principal de la farmacogenética és optimitzar el tractament individual i aconseguir una teràpia personalitzada eficaç i segura, determinant la influència de la genètica de cada persona en la resposta dels fàrmacs. Aquest coneixement pot canviar la manera de receptar fàrmacs en la pràctica clínica diària. La farmacogenética permet realitzar una preselecció dels pacients que responguin a un tractament i de la dosi més adequada d'aquests. És a dir, permetrà seleccionar el fàrmac adequat a la dosi adequada per al pacient al qual pertany (Figura 1). D'aquesta forma es pot evitar l'ús innecessari i els efectes secundaris dels medicaments.
La genètica: font de la diversitat
Igual que ocorre amb el cafè, en el cas dels fàrmacs, classifiquem als individus en tres grups: metabolizadores ràpids, que eliminen substàncies a gran velocitat; metabolizadores comuns, que les expulsen a una velocitat adequada; i metabolizadores lents, que eliminen algunes substàncies de manera ineficient. En aquest últim cas, les substàncies romanen més temps del necessari en el cos. En el cas del cafè, això provoca la incapacitat de dormir, mentre que en el cas dels fàrmacs pot provocar efectes tòxics. En l'ésser humà s'encarreguen de metabolizar el cafè i molts fàrmacs. Entre aquests enzims, les famílies CYP2 i CYP3 tenen especial importància a l'hora de metabolizar els fàrmacs. Aquestes dues famílies d'enzims presenten petites variacions d'un individu a un altre. Aquestes variacions poden ser degudes a petites variacions en la seqüència gènica (SNP, polimorfismes mononucleòtids) o a la duplicació o pèrdua de gens sencers (CNV, variacions en el nombre de còpies). Aquestes variacions poden donar lloc a la formació de diferents proteïnes o a la modificació de la quantitat de proteïnes. Com a conseqüència, l'efectivitat del metabolisme dels fàrmacs varia i el seu efecte dura més o menys temps. En altres paraules, les diferències individuals que es produeixen en l'activitat del citocrom P450 seran les responsables de l'eficàcia i seguretat d'un fàrmac. Això depèn en part de la quantitat de fàrmac present en la sang. Els Citocrom P450 a més del cafè, metabolizan els fàrmacs utilitzats en càncer, malalties psiquiàtriques, etc. Actualment existeixen xips comercials que ens permeten conèixer la seqüència CYP de cada individu i determinar el tipus de metabolizador.
Un xip d'ADN es basa en una superfície sòlida (vidre, plàstic, silici) amb micropozos. En cada pou, a través dels dispensores automàtics, se situa la coneguda seqüencia d'ADN. En el cas de les recerques farmacogenéticas, en aquests pous s'estableixen seqüències d'ADN que poden tenir individus i que afecten la resposta dels fàrmacs. Per a l'anàlisi de l'ADN d'un individu n'hi ha prou amb una mostra de teixit (sang o saliva). Una vegada obtinguda la mostra, es trenquen les cèl·lules i s'extreu l'ADN del nucli. Posteriorment, aquest ADN es marca amb molècules fluorescents i es col·loca en pous. Però només es pegarà en pous amb la mateixa seqüència. Llavors, aquests pous emetran lluentor i, atès que la seqüència corresponent a cada pou és coneguda, podrem conèixer també la seqüència individual.
Variabilitat de la resposta
A més d'aquests gens, existeixen gens relacionats amb la velocitat d'absorció i eliminació (farmacocinètica), així com amb la resposta d'un fàrmac a les diferents parts del cos (farmacodinámica). Per això, les diferents respostes als fàrmacs poden ser causades per quatre fets. D'una banda, canvis en les seqüències gèniques dels metabolizadores dels enzims; per un altre, canvis en els transportadors i receptors dels fàrmacs; i finalment, canvis en les proteïnes que tenen certa relació amb la resposta del fàrmac.
Èxit de la farmacogenética
Un exemple de l'èxit de la teràpia personalitzada és el tractament de Trastuzumab en càncer de mama. En el 20% dels càncers de mama que es diagnostiquen en l'actualitat, el gen HER2 ( epidermal growth factor receptor 2) està duplicat. Això suposa que el receptor dels factors de creixement que codifica el gen estigui superposat i augmenti el nombre de receptors. Trastuzumab bloqueja als receptors i han demostrat que només prolonga la seva supervivència en pacients amb HER2 duplicat.
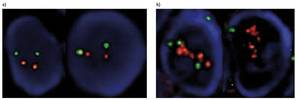
Existeixen diferents mètodes per a detectar pacients amb augment de proteïnes. Una d'elles és la hibridació fluorescent in situ (FISH), en la qual el gen es veu marcat fluorescentment. D'aquesta forma, en lloc d'existir dues còpies del gen, es poden detectar casos en els quals existeixen nombroses còpies (figura 2). En pacients que no tenen el gen HER2 duplicat, Trastuzumab no té cap benefici, però sí un alt cost.
Quant a la seguretat, se sap que un 15% dels pacients sofreixen efectes secundaris derivats del fàrmac. En pacients amb càncer colorectal, per exemple en pacients amb variant de gen UGT1A1, el fàrmac Irinoteca es metaboliza malament. Com a conseqüència d'això, l'administració de dosis normals a aquests pacients comportarà l'acumulació d'Irinotecan en el cos i la neutropènia (disminució de neutròfils). Els estudis farmacogenéticos han permès determinar la dosi adequada. Una anàlisi de l'ADN ens permet conèixer en unes poques hores la variació del gen i determinar la dosi adequada.
Com s'ha vist, la farmacogenética és fonamental per a identificar el fàrmac eficaç per al pacient i determinar la seva dosi, evitant així els efectes secundaris. El que fa uns anys semblava un somni, avui dia és una realitat. L'Associació d'Aliments i Medicaments dels Estats Units (FDA) ja recomana la inclusió d'informació farmacogenética en l'etiqueta dels envasos dels fàrmacs. En concret, en la pàgina web del FDA s'inclou un llistat de 116 fàrmacs en els quals s'indiquen en els seus envasos les accions específiques d'informació genètica a tenir en compte. (http://www.fda.gov/drugs/scienceresearch/researchareas/pharmacogenetics/ucm083378.htm).
El nostre equip de recerca treballa en la farmacogenética dels càncers infantils i en concret en la leucèmia linfoblástica aguda (LLA). En aquesta malaltia es tracta de localitzar indicadors genètics que influeixen en la toxicitat del metotrexato antineoplásico, un dels fàrmacs més importants utilitzats en el tractament d'aquests nens. De fet, aquest fàrmac s'utilitza en altes dosis, ja que la majoria dels nens el suporten bé i s'ha demostrat que aquesta dura forma d'administració augmenta la seva supervivència. No obstant això, a alguns nens aquestes dosis els produeixen efectes tòxics molt greus fins a arribar a ser letals. Per això, un dels nostres objectius és trobar indicadors genètics que ens permetin predir els efectes secundaris.
Bibliografia
Agraïment
Els autors del present treball han rebut subvencions del Govern Basc (IT-199/07, SAIOTEK S-PE10UN14) i de la Universitat del País Basc (UFI 11/35). Gràcies a Maialen Martin Arruti (Anatomia Patològica, Hospital Universitari Donostia).