Deuda con relatividad
A pesar de que la velocidad de la luz es insuperable, los efectos relativistas asociados a su proximidad tienen una repercusión directa en la vida cotidiana. Estos efectos son, por ejemplo, los principales responsables del color del oro, tan apreciado en el mundo de la joyería, y del carácter líquido del mercurio utilizado en los termómetros. ¿Qué son esos efectos relativistas y qué relación hay entre esos efectos y esas características distintivas de los metales mencionados?
300.000 km/s, es una velocidad inmensa. Por poner algunos ejemplos, a esa velocidad, en un solo segundo dábamos al mundo siete vueltas, o la distancia de la Luna a la Tierra se formaría en casi un segundo. Sin duda, estas velocidades no están en nuestras manos. Por ejemplo, el aparcamiento Curiosity llegó recientemente a Marte, a una velocidad media de 12.000 km/h, lo que supone 90.000 veces la velocidad de la luz.
Sin embargo, en el mundo atómico existen partículas que se aproximan a esta velocidad hasta las consecuencias que ello conlleva. Así, en el caso de los átomos pesados como platino, oro, mercurio o uranio, la elevada carga positiva que se acumula en el núcleo hace que los electrones más próximos al núcleo se muevan muy rápidamente, cerca de la velocidad de la luz.
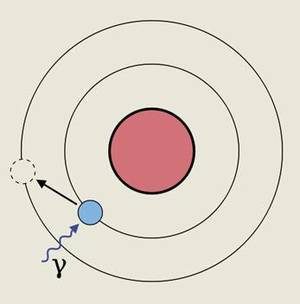
Como se puede deducir de la teoría de la relatividad de Einstein, en estos casos la masa del electrón aumenta, siendo ésta la principal fuente de los efectos relativistas que se ven en el caso de los átomos pesados. Esto se debe a que al aumentar la masa de los electrones que se encuentran cerca del núcleo, sus orbitales disminuyen. Esto provoca, a su vez, la contracción y ampliación de algunos de los orbitales superficiales que intervienen en la química de un átomo y la modificación del nivel energético de los electrones contenidos en ellos. Esto permite aumentar o disminuir el nivel de energía que deben absorber los electrones para pasar de un nivel de energía a otro.
La contracción y ampliación de los orbitales superficiales de los átomos pesados, así como el consiguiente cambio en el nivel de energía, dan lugar a propiedades de elementos pesados que de otra manera no aparecerían.
El color del oro
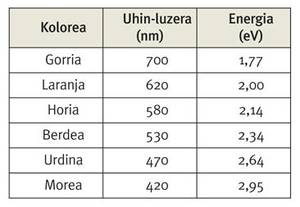
Una de estas características es el color natural del oro, tan valioso en joyería. Esto se debe a que, en este caso, estas expansiones y contracciones de los orbitales superficiales hacen que un electrón de la superficie pase de un orbital o nivel energético a otro. De hecho, la energía que debe absorber este electrón para dar el salto mencionado es del orden de 2,7 eV, valor que se encuentra entre las energías de la luz morada y la azul.
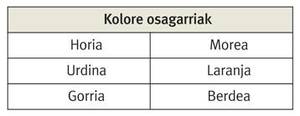
Para comprender el amarillento del oro hay que tener en cuenta que este color es complementario del violeta, es decir, si quitamos el componente morado de la luz blanca, nosotros vemos el amarillo y viceversa.
Por lo tanto, cuando irradiamos oro con luz blanca, esto absorbe los fotones entre el color azul y el violeta, y nosotros vemos el resto de la luz reflejada en esa superficie dorada.
¿Pero qué relación hay entre todo esto y los efectos relativistas? Analicemos, pues, el intervalo de energía correspondiente a este salto de un orbital a otro en elementos más ligeros como el oro, es decir, en el caso del cobre y la plata situados sobre el oro en la tabla periódica. Así, en el caso del cobre este rango energético se sitúa en torno a 1,4 eV, mientras que en el caso de la plata se sitúa en torno a 3,7 eV. Adviértase que ambos valores quedan fuera del rango de energía de la luz visible. En el caso del cobre y la plata, los efectos relativistas no son tan importantes, pero si no los hay, a medida que vamos descendiendo en la tabla periódica, habría que aumentar el rango de energía correspondiente a dicho salto. Así, si estos efectos relativistas no existieran, el electrón mencionado en el caso del oro debería absorber más energía que en los otros dos casos para dar ese salto. En la realidad, sin embargo, los efectos relativistas hacen que los niveles de energía o de los orbitales que entran en juego en este salto estén más cerca de lo que deberían, situando su separación entre el cobre y la plata. Casualmente, para el disfrute de nuestros ojos, en el caso del oro, ese salto energético queda cerca del nivel energético de la luz morada, y nosotros percibimos el color amarillo.
Mercurio líquido
Otro ejemplo significativo es el del mercurio. Este metal, utilizado en aparatos de medida de temperatura y presión, es extraño, a diferencia de otros metales, ya que es líquido a temperatura ambiente. Y este matiz también es consecuencia directa de los efectos relativistas.
De hecho, la contracción del último orbital de la superficie del mercurio ocupado por dos electrones hace que los electrones allí contenidos estén fuertemente unidos al núcleo más fuertemente que los que se podrían encontrar en ausencia de efectos relativistas. El efecto de la contracción de este orbital sobre esta característica se verá más claramente si comparamos la energía de ionización del mercurio, es decir, la energía necesaria para eliminar un electrón, con la del cadmio y la del zinc, que son más ligeros que sus pares. Así, teniendo en cuenta que la energía de ionización del zinc, situada dos líneas por encima, es de 9,42 eV y que la del cadmio, justo encima del mercurio, es de 9,03 eV, se debería esperar que la de mercurio sea inferior a estos dos valores. Sin embargo, la contracción del citado orbital provoca que la energía de ionización del mercurio sea del orden de 10,51 eV, muy superior a la de los otros dos de su grupo.
Para comprender la relación que tiene con todo esto el hecho de que el mercurio sea líquido a temperatura ambiente, conviene recordar la estructura de los metales sólidos. Así, cuando están en estado sólido, los metales liberan los electrones sobrantes y crean las bandas de electrones correspondientes a todos los átomos. Por tanto, en un metal el núcleo y los electrones internos se ubican en un punto determinado y los electrones que liberan tienen libertad para moverse por todo el metal alrededor de esos puntos concretos. Esta estructura es la principal responsable de la elevada conductividad eléctrica y térmica de los metales.
En el caso del mercurio, por el contrario, la contracción del último orbital ocupado impide la existencia de esta estructura, ya que los dos electrones locales no pueden quedar libres, como ocurriría si no existiera este efecto relativista. En consecuencia, el mercurio se encuentra en estado líquido a temperatura ambiente.

...y mucho más
Sin embargo, el amarillento del oro y el carácter líquido del mercurio son sólo dos ejemplos de las consecuencias de los efectos relativistas. Más allá de estos dos casos, estos efectos condicionan mucho la química de los elementos pesados. Así, los efectos relativistas hacen posible que estos elementos pesados puedan reaccionar de otra manera. Asimismo, el diferente comportamiento químico de los elementos pesados y asimilables más ligeros (platino/paladio, oro/plata, mercurio/cadmio...) se debe en parte a estos efectos.
Por tanto, aunque la velocidad de la luz parece una cuestión de ficción, los efectos relacionados con ella están muy presentes en nuestra vida cotidiana. Por lo tanto, podríamos decir, en cierta medida, que los seres humanos estamos en deuda con esos efectos relativistas.