Biokatalizatzaileak, industria jasangarriago bat lortzeko

Izatez, urteak beharko genituzke gure zeluletan segundoero gertatzen diren prozesuak lortzeko. Guztiz oharkabean egiten dugun zerbait izanik ere, miragarria da edozein erreakzioren abiadura nola aldatzen den gure gorputzean gertatzen denean. Adibidez, gure odolean CO2-a garraiatzeko globulu gorriek etengabe egiten duten erreakzio bat, bikarbonatoaren deshidratazioa (1. irudia), milioika aldiz mantsoago gertatzen da ingurunean [1].
Zein da gure sekretua? Nola lortzen dugu abiadura hori? Erreakzioak azkartu edo katalizatzeaz arduratzen diren molekulak sortzen ditugu bizidunok, biokatalizatzaile edo entzima deritzenak. Sinonimoak ez diren arren, biokatalizatzaile gehienak entzimak dira, hau da, aktibitate katalitikoa duten proteinak.
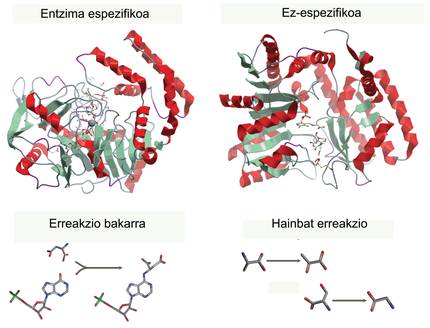
Prozesu bakoitzerako, entzima espezifiko bat dago, erreakzio bat eta bakarra katalizatzen duena (erreaktibo-mota bakarra erabili eta produktu bakarra sortzeko), eta, ondorioz, entzima batek ezin ditu bi produktu ekoitzi. Ezagutzen diren katalizatzaile eraginkor eta boteretsuenak dira (edozein katalizatzaile ez-organiko baino askoz indartsuagoak), eta, antzinatik erabiltzen ditugun arren, azken urteotan gertatu den garapenari esker, gaur egun aplikazio ugari dituzten molekulak dira. Eguneroko bizitzako hainbat produkturen ekoizpen industriala hobetzeko baliatzen ditugu.
Entzimen erabilera industrialaren adibide asko ditugu inguruan, ia oharkabean merkatuan sartu direnak. Batzuk janariaren tratamendu industrialerako erabiltzen dira, laktosarik gabeko esnearen ekoizpena, kasurako. Beste erabilpen ezagun bat kalitate-kontroletan erabiltzen diren neurketak dira, zeinetako gehienak entzimaren baten aktibitatean oinarritzen diren. Horretaz gain, industria farmazeutikoan, farmakoen ekoizpen espezifikoagoa lortzeko erabil daitezke entzimak. Entzimek substratu bakarra erabiltzen dute produktu bakarra sortzeko, eta, ondorioz, sintesi kimiko batean sortzen diren molekula-nahasteak ekiditen dira (estereoespezifikoak dira); kasu batzuetan, albo-produktu arriskutsuak ekiditea lortzen da. Dena den, aplikazio-esparru zabalena prozesu industrialen jasangarritasuna hobetzean datza, produktu kimikoak era ekologikoagoan sortzeko (kutsatzen ez duten prozesuen bidez, baldintza biologikoetan). Gainera, garbiketa-prozesuak hobetzen (ur hotzetan lixiba egiteko garbigarriak) edo inguruneko kutsadura arintzen lagundu dezaketen entzima ugari ekoizten dira.
Dena den, naturan ez dira beti aurkitzen gure interesekoak diren prozesuak katalizatzen dituzten entzimak. Esan dugun moduan, entzima bakoitzak substratu-mota bakarra ezagutzen du, eta produktu bakar eta espezifikoa ematen, eta industrialki interesgarriak diren hainbat erreakzio ez dira izaki bizidunetan gertatzen. Ondorioz, entzima berriak sortu edo genituenak hobetzen hasiak gara, entzimei buruz dakiguna eta eskura ditugun teknologiak profitatuz. Orain arte, bide ohikoena izan da aurretiaz ezagutzen genituen entzimak optimizatzea. Fruta-arbolak edo landareak hobetzeko egiten den bezala, proteinetan mutazioak eragiten dira, eta, ondoren, gustuko ezaugarriak dituzten entzimak hautatu. Metodologia horri eboluzio zuzendua esaten zaio. Batzuetan, mutazioak berariaz puntu jakin batzuetan egiten dira, eta, kasu horretan, esaten da diseinu arrazionala erabili dela. Dena den, hutsetik entzima berriak diseinatzea gero eta ohikoagoa ari da bihurtzen, eta, teorikoki, metodologia horrek izugarri zabalduko lituzke biokatalizatzaile berriak lortzeko aukerak [2].
Makina bat diseinatzeko prozesua ulertzea ezinbestekoa den moduan, biokatalizatzaile egoki bat sintetizatu ahal izateko beharrezkoa da haren funtzionamendu eta egitura guztiz ulertzea. Eta zer da zehazki molekula horiei buruz dakiguna?
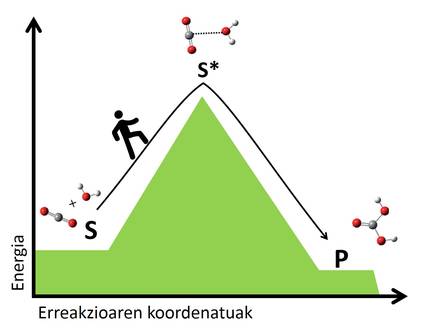
Trantsizio-egoeraren teoriaren arabera, erreakzio guztietan berrantolatzen dira erreaktiboen atomoak, loturak hautsi eta berriak sortuz, beste molekula batzuk osatzeko. Berrantolaketa horretan, trantsizio-egoerak sortzen dira, non erreaktibo eta produktuen erdibideko atomo-antolaketak osatzen diren. Trantsizio-egoeran dauden molekulak, orokorrean, molekula ezegonkorrak dira, eta erreaktiboetatik trantsizio-egoerara iristeko, energia asko behar izaten da. Zenbat eta energia-jauzi handiagoa izan trantsizio-egoerara iristeko, orduan eta geldoagoa izango da erreakzioa. Bailara batetik bestera igarotzea bezalakoa da, zenbat eta gailur garaiagoa iragan behar izan, orduan eta luzeagoa izango da bidaia (2. irudia).
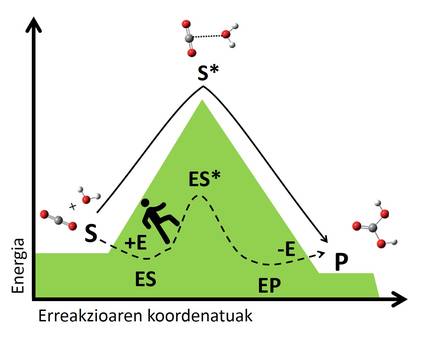
Trantsizio-egoera horiek substratuarekin elkarrekintzak sortuz egonkortzean datza biokatalizatzaileen mekanismoaren sekretua. Entzima substratuari batzen zaio, konplexu bat osatuz, eta batura horrek erreakziobide berri bat sortzen du, aurrez existitzen ez zena (3. irudia). Konplexua egonkorragoa da entzima eta substratu askeak osatzen duten sistema baino, eta egonkortasun horrek trantsizio-egoerara iristeko behar den energia-jauzia txikitzen du, eta, ondorioz, erreakziobide azkarrago bat sortzen du. Aurreko adibideari jarraituz, bailara batetik bestera gurutzatzeko bidezidor bat aurkitzearen antzera uler genezake, gailurrera igo eta jaistea baino energia gutxiago eskatzen digun bidea denez, azkarrago iritsiko gara bestaldera.
Hala, erreakzio bat katalizatzeko entzima bat diseinatu nahiko bagenu, erreakzioaren trantsizio-egoerarekin bateragarria den egitura bat beharko genuke: molekula egonkortzeko moduko elkarrekintzak osatzeko gai izango den zerbait, konplexua egonkortu eta erreakzioa azkartzeko baliagarria izango dena. Hori behar bezala gertatzeko, substratuarekin elkarrekintzak osatzeko atomo aproposak hautatzeaz gain (kasuan kasuko ezaugarri kimiko berezidunak), atomoek espazioan posizio eta angelu jakin batean kokaturik egon behar dute, hiru dimentsioko sare espezifiko bat osatuz [3].
Orokorrean, katalisia gauzatzen duen gunea (gune katalitikoa) oso txikia izaten da, molekularen bolumen osoarekin alderatuz gero. Adibide gisa, CO2-aren hidratazioa katalizatzen duen entzima azter dezakegu, anhidrasa karbonikoa (4. irudia). Ikus daitekeenez, substratuarekin elkarrekintza duen gunea oso txikia da, entzima osoaren bolumena kontuan hartzen badugu.
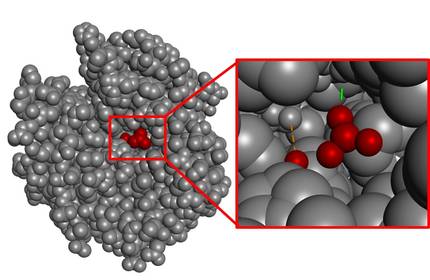
Jakina da naturak ez duela inoiz energia alferrik xahutzen. Ondorioz, gune katalitikoa ez den gainontzeko egitura ez genuke soberakin gisa ulertu behar, gune katalitiko perfektua lortzeak dakarren konplexutasunaren adierazletzat baizik. Izan ere, egitura horren atomo urrunekoenean gerta litezkeen aldaketek ere gune katalitikoa desegin lezakete. Beste modu batera esanda, egitura osoa behar-beharrezkoa da entzimak aktibitatea izan dezan, eta prozesu konplexua da horrelako molekula handiak hutsetik diseinatzen hastea.
Gai horretan, ekarpen handia egin du bioinformatikaren eta biologia estrukturalaren garapenak. Gaur egun, mekanika kuantikoari esker, erreakzio baten trantsizio-egoera kalkulatu, bateragarri zaion gune aktiboa simulatu eta egitura osatzeko beharko genukeen proteina-egitura diseina ditzakegu.
Metodologia horri esker, biokatalizatzaile ezagunik ez duten erreakzioak katalizatzea lortu da, eta egiaztatu da posible dela prozesu hori gauzatzea. Gainera, proteinen egiturari buruz dugun ezagupena zabaltzen lagundu dute teknika horiek. Dena den, lortutako adibide horien katalisi-ezaugarriak ez dira entzima naturalen aktibitate-mailara iristen, orokorrean, katalisi-gaitasun murritzagoa dute [4].
Ondorioz, hobetzeko asko dagoen arren, biokatalizatzaile berriak diseinatzeak gaitasuna ematen digu gure intereseko edozein prozesuren abiadura kontrolatzeko. Teknika horiei esker, prozesu industrialak tenperatura baxuagoetan, disolbatzaile organikoen beharrik gabe, efizientzia hobearekin, ur gutxiagorekin eta hondakin kutsagarri gutxiago sortuz egin daitezke. Beraz, bizitzaren nanomakinak diseina ditzakegu, industria mailako prozesuak bizitzarekin bateragarri izan daitezen.
Bibliografia
[1] Albert L. Lehninger, David L. Nelson eta Michael M. Cox. Biokimikaren oinarriak (2008), Euskal Herriko Unibertsitatea, 1.go edizioa.
[2] Po-Ssu Huang, Scott E. Boyken eta David Baker. The coming of age of de novo protein design. Nature (2016), 537(7620):320-7.
[3] Karlheinz Drauz, Harald Gröger eta Oliver May. Enzyme catalysis in organic synthesis (2012), Wiley-VCH.
[4] Kiss G, Çelebi-Ölçüm N, Moretti R, Baker D, Houk KN. Computational enzyme design. Angewandte Chemie International Edition in English (2013), 52(22):5700-25.
Idatzi zuk zeuk Gai librean atalean
Gai librean aritzeko, bidali zure artikulua aldizkaria@elhuyar.eus helbidera
Hauek dira Gai librean atalean Idazteko arauak
Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia