Biocatalisateurs pour une industrie plus durable

En fait, nous aurions besoin d'années pour obtenir des processus qui se produisent chaque seconde dans nos cellules. C'est merveilleux comment la vitesse de toute réaction change quand elle se produit dans notre corps. Par exemple, une réaction continue des globules rouges pour transporter du CO2 dans notre sang, la déshydratation du bicarbonate (figure 1), se produit des millions de fois plus lentement au milieu [1].
Quel est notre secret? Comment obtenons-nous cette vitesse ? Les êtres vivants forment des molécules chargées d'accélérer ou de catalyser les réactions, appelées biocatalyseurs ou enzymes. Bien qu'ils ne soient pas synonymes, la plupart des biocatalisateurs sont des enzymes, c'est-à-dire des protéines à activité catalytique.
Pour chaque processus, il y a une enzyme spécifique qui catalyse une seule et même réaction (pour utiliser un seul type de réactif et créer un seul produit), donc une enzyme ne peut pas produire deux produits. Ils sont les catalyseurs les plus efficaces et puissants connus (beaucoup plus puissants que n'importe quel catalyseur inorganique) et, même si nous les utilisons depuis des temps anciens, le développement expérimenté ces dernières années a fait de nos jours des molécules avec de nombreuses applications. Nous les utilisons pour améliorer la production industrielle de différents produits de la vie quotidienne.
Autour de nous se trouvent de nombreux exemples d'utilisation industrielle des enzymes, qui sont entrées presque inconsciemment sur le marché. Certains sont utilisés pour le traitement industriel de la nourriture, comme la production de lait sans lactose. Une autre utilisation connue sont les mesures utilisées dans les contrôles de qualité, dont la plupart sont basées sur l'activité d'une enzyme. En outre, dans l'industrie pharmaceutique, les enzymes peuvent être utilisées pour obtenir une production plus spécifique de médicaments. Les enzymes utilisent un seul substrat pour former un seul produit, ce qui évite les mélanges moléculaires (stéréo) générés dans une synthèse chimique, en évitant dans certains cas des produits secondaires dangereux. Cependant, le champ d'application le plus large est axé sur l'amélioration de la durabilité des processus industriels pour la génération plus écologique de produits chimiques (par des processus non polluants dans des conditions biologiques). En outre, de nombreuses enzymes peuvent aider à améliorer les processus de lavage (détergents pour eau froide) ou à atténuer la pollution de l'environnement.
Cependant, dans la nature, il n'y a pas toujours d'enzymes qui catalysent les processus de notre intérêt. Comme il a été dit, chaque enzyme connaît un seul type de substrat, fournissant un produit unique et spécifique, et diverses réactions d'intérêt industriel ne sont pas donnés dans les êtres vivants. Par conséquent, nous avons commencé à créer de nouvelles enzymes ou à améliorer celles que nous avions, en profitant de la connaissance des enzymes et des technologies disponibles. Jusqu'à présent, la voie la plus courante a été d'optimiser les enzymes que nous connaissions déjà. Comme pour l'amélioration des fruitiers ou des plantes, des mutations sont produites dans les protéines et les enzymes de caractéristiques préférées sont sélectionnées. Cette méthodologie est appelée évolution corrigée. Parfois, les mutations sont effectuées spécifiquement à certains points, auquel cas on dit qu'une conception rationnelle a été utilisée. Cependant, la conception de nouvelles enzymes depuis le vide devient de plus en plus une méthodologie qui étend théoriquement énormément les possibilités d'obtenir de nouveaux biocatalisateurs [2].
Comme il est indispensable de comprendre le processus de conception d'une machine, pour pouvoir synthétiser un biocatalyseur adéquat il faut comprendre pleinement son fonctionnement et sa structure. Et que savons-nous exactement de ces molécules ?
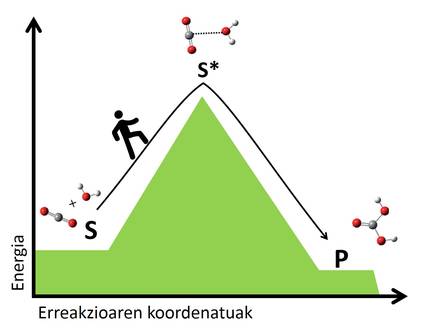
Selon la théorie de l'état de transition, toutes les réactions sont réordonnées les atomes des réactifs, brisant les liens et formant de nouvelles molécules. Cette réorganisation crée des états transitoires dans lesquels se forment les formations atomiques intermédiaires de réactifs et de produits. Les molécules en transition sont généralement instables et nécessitent beaucoup d'énergie pour atteindre un état de transition des réactifs. Plus le saut énergétique atteint l'état de transition, plus la réaction est lente. C'est comme passer d'une vallée à l'autre, plus le passage est élevé, plus le voyage est long (Figure 2).
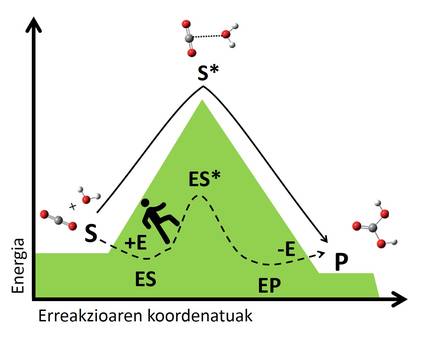
Le mécanisme des biocatalisateurs est basé sur la stabilisation de ces situations de transition par des interactions avec le substrat. L'enzyme rejoint le substrat en formant un complexe qui crée une nouvelle voie de réaction inexistante (Figure 3). La complexité est plus stable que le système formé par l'enzyme et le substrat libre, et cette stabilité réduit le saut énergétique nécessaire pour atteindre l'état de transition, conduisant à une voie de réaction plus rapide. En suivant l'exemple ci-dessus, nous pourrions comprendre comment trouver un chemin qui nous traverse d'une vallée à l'autre, car c'est un chemin qui exige moins d'énergie que de monter et descendre au sommet, donc nous arriverons plus vite de l'autre côté.
Ainsi, si nous voulions concevoir une enzyme pour catalyser une réaction, nous aurions besoin d'une structure compatible avec l'état de transition de la réaction : quelque chose capable de compléter des interactions stabilisatrices de molécule, qui servirait à stabiliser le complexe et à accélérer la réaction. Pour que cela se produise correctement, en plus de sélectionner les atomes appropriés pour compléter les interactions avec le substrat (avec leurs caractéristiques chimiques spécifiques), les atomes doivent être situés dans l'espace dans une position et un angle déterminés, formant un réseau spécifique en trois dimensions [3].
En général, la zone de catalyse (zone catalytique) est très petite par rapport au volume total de la molécule. A titre d'exemple, nous pouvons analyser l'enzyme qui catalyse l'hydratation de CO2, l'anhydrase carbonique (Figure 4). Comme vous pouvez le constater, la zone d'interaction avec le substrat est très petite si l'on tient compte du volume de toute l'enzyme.
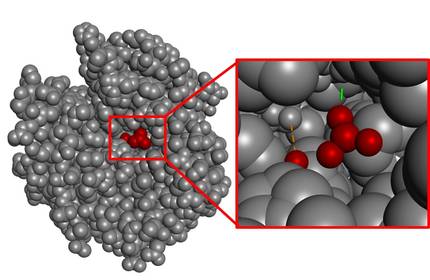
On sait que la nature ne gaspille jamais d'énergie. Par conséquent, le reste de la structure qui n'est pas l'espace catalytique ne devrait pas être compris comme un excédent, mais comme un indicateur de la complexité qui suppose la réalisation de l'espace catalan parfait. En fait, les changements possibles dans l'atome le plus éloigné de cette structure pourraient également détruire la zone catalytique. Autrement dit, toute la structure est indispensable pour que l'enzyme soit active et c'est un processus complexe de commencer à concevoir ce type de grandes molécules à partir de zéro.
En ce sens, le développement de la bioinformatique et de la biologie structurelle a contribué de manière importante. Actuellement, la mécanique quantique permet de calculer l'état de transition d'une réaction, simuler la zone active compatible et concevoir la structure protéique qui serait nécessaire pour compléter la structure.
Cette méthodologie a permis de catalyser des réactions sans biocatalyseur connu et de vérifier que ce processus est possible. En outre, ces techniques ont contribué à élargir notre connaissance de la structure des protéines. Cependant, les caractéristiques catalytiques de ces exemples obtenus n'atteignent pas le niveau d'activité des enzymes naturelles, ils ont généralement une capacité de catalyse plus réduite [4].
Par conséquent, même s'il y a beaucoup à améliorer, la conception de nouveaux biocatalisateurs nous permet de contrôler la vitesse de tout processus de notre intérêt. Ces techniques permettent aux processus industriels de réaliser à des températures inférieures, sans besoin de solvants organiques, avec une meilleure efficacité, avec moins d'eau et avec moins de résidus polluants. Par conséquent, nous pouvons concevoir les nanombres de la vie afin que les processus industriels soient compatibles avec la vie.
Bibliographie Bibliographie
[1] Albert L. Lehninger, David L. Nelson et Michael M. Cox. Fondations de Biochimie (2008), Université du Pays Basque, 1ère édition.
[2] Po-Ssu Huang, Scott E. Boyken et David Baker. - Nature (2016), 537 (7620):320-7.
[3] Karlheinz Drauz, Harald Gröger et Oliver May. Enzyme catalysis in organic synthesis (2012), Wiley-VCH.
[4] Kiss G, Çelebi-Ölçüm N, Moretti R, Baker D, Houk KN. Computational enzyme design. Angewandte Chemie International Edition in English (2013), 52(22):5700-25.





