Biocatalizadores paira una industria máis sustentable

De feito, necesitariamos anos paira conseguir procesos que se producen cada segundo nas nosas células. É marabilloso como cambia a velocidade de calquera reacción cando ocorre no noso corpo. Por exemplo, una reacción continua dos glóbulos vermellos paira transportar CO2 no noso sangue, a deshidratación do bicarbonato (Figura 1), prodúcese millóns de veces máis lentamente no medio [1].
Cal é o noso segredo? Como conseguimos esa velocidade? Os seres vivos formamos moléculas encargadas de acelerar ou catalizar as reaccións, chamadas biocatalizadores ou encimas. Aínda que non son sinónimos, a maioría dos biocatalizadores son encimas, é dicir, proteínas con actividade catalítica.
Paira cada proceso hai una encima específica que cataliza una e una soa reacción (paira utilizar un único tipo de reactivo e crear un único produto), polo que una encima non pode producir dous produtos. Son os catalizadores máis eficientes e poderosos coñecidos (moito máis potentes que calquera catalizador inorgánico) e, aínda que os utilizamos desde tempos remotos, o desenvolvemento experimentado nos últimos anos fixo que hoxe en día sexan moléculas con moitas aplicacións. Utilizámolas paira mellorar a produción industrial de diferentes produtos da vida diaria.
Ao noso ao redor atópanse moitos exemplos de uso industrial das encimas, que entraron case inconscientemente no mercado. Algúns se utilizan paira o tratamento industrial da comida, como a produción de leite sen lactosa. Outro uso coñecido son as medicións utilizadas nos controis de calidade, a maioría das cales se basean na actividade dalgunha encima. Ademais, na industria farmacéutica, as encimas poden utilizarse paira obter una produción máis específica de fármacos. As encimas utilizan un único substrato paira formar un único produto, polo que se evitan as mesturas moleculares (estereoespecíficas) que se xeran nunha síntese química, evitando nalgúns casos produtos secundarios perigosos. Con todo, o ámbito de aplicación máis amplo céntrase na mellora da sustentabilidade dos procesos industriais paira a xeración máis ecolóxica de produtos químicos (mediante procesos non contaminantes en condicións biolóxicas). Ademais, prodúcense numerosas encimas que poden axudar a mellorar os procesos de lavado (deterxentes paira lejía en augas frías) ou mitigar a contaminación ambiental.
Con todo, na natureza non sempre se atopan encimas que catalizan procesos do noso interese. Como se dixo, cada encima coñece un único tipo de substrato, proporcionando un produto único e específico, e diversas reaccións de interese industrial non se dan nos seres vivos. Por tanto, empezamos a crear novas encimas ou a mellorar as que tiñamos, aproveitando o coñecemento das encimas e as tecnoloxías dispoñibles. Até agora, a vía máis común foi a de optimizar as encimas que xa coñeciamos. Do mesmo xeito que se fai paira a mellora de froiteiras ou plantas, prodúcense mutacións nas proteínas e selecciónanse as encimas de características preferidas. Esta metodoloxía denomínase evolución corrixida. En ocasións, as mutacións realízanse especificamente en determinados puntos, nese caso dise que se utilizou un deseño racional. Con todo, o deseño de novas encimas desde o baleiro está a converterse cada vez máis nunha metodoloxía que teoricamente estendería enormemente as posibilidades de obter novos biocatalizadores [2].
Tal e como é imprescindible comprender o proceso de deseño dunha máquina, paira poder sintetizar un biocatalizador adecuado é necesario comprender plenamente o seu funcionamento e estrutura. E que é exactamente o que sabemos sobre estas moléculas?
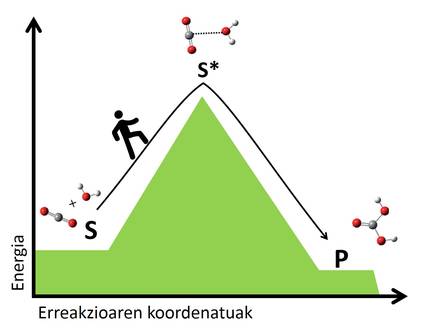
Segundo a teoría do estado de transición, en todas as reaccións reordénanse os átomos dos reactivos, rompendo enlácelos e formando novas moléculas. Nesta reorganización créanse estados de transición nos que se forman as formacións atómicas intermedias de reactivos e produtos. As moléculas en transición son, en xeral, inestables e requiren moita enerxía paira chegar a un estado de transición desde os reactivos. Canto maior sexa o salto enerxético paira chegar ao estado de transición, máis lento será a reacción. É como pasar dun val a outro, canto máis alto sexa o paso, máis longo será a viaxe (figura 2).
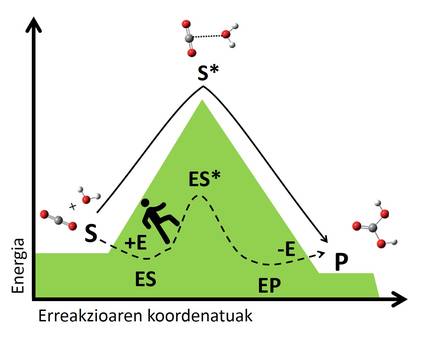
O mecanismo dos biocatalizadores baséase na estabilización destas situacións de transición mediante interaccións co substrato. A encima únese ao substrato formando un complexo que crea una nova vía de reacción inexistente (Figura 3). A complexidade é máis estable que o sistema formado pola encima e o substrato libre, e esta estabilidade reduce o salto enerxético necesario paira chegar ao estado de transición, dando lugar a unha vía de reacción máis rápida. Seguindo o exemplo anterior, poderiamos entender como atopar un carreiro que nos cruza dun val a outro, xa que é un camiño que nos esixe menos enerxía que subir e baixar á cima, polo que chegaremos máis rápido alén.
Así, se quixésemos deseñar una encima paira catalizar unha reacción, necesitariamos una estrutura compatible co estado de transición da reacción: algo capaz de completar interaccións estabilizadoras da molécula, que servise paira estabilizar o complexo e acelerar a reacción. Para que isto ocorra correctamente, ademais de seleccionar os átomos apropiados paira completar as interaccións co substrato (coas súas características químicas específicas), os átomos deben estar situados no espazo nunha posición e ángulo determinados, formando una rede específica tridimensional [3].
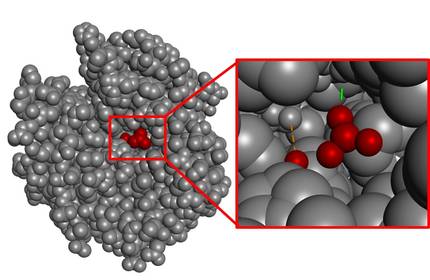
En xeral, a zona de catálisis (zona catalítica) é moi pequena en comparación co volume total da molécula. A modo de exemplo, podemos analizar a encima que cataliza a hidratación de CO2, a anhidrasa carbónica (Figura 4). Como se pode observar, a zona de interacción co substrato é moi pequena se se ten en conta o volume de toda a encima.
Sábese que a natureza nunca malgasta enerxía. En consecuencia, o resto da estrutura que non é o espazo catalítico non debería entenderse como un excedente, senón como un indicador da complexidade que supón a consecución do espazo catalán perfecto. De feito, os posibles cambios no átomo máis afastado desta estrutura tamén poderían destruír a zona catalítica. Dito doutro xeito, toda a estrutura é imprescindible para que a encima teña actividade e é un proceso complexo empezar a deseñar este tipo de moléculas grandes desde cero.
Neste sentido, o desenvolvemento da bioinformática e a bioloxía estrutural ha contribuído de maneira importante. Na actualidade, a mecánica cuántica permite calcular o estado de transición dunha reacción, simular a zona activa compatible e deseñar a estrutura proteica que sería necesaria paira completar a estrutura.
Esta metodoloxía permitiu catalizar reaccións sen biocatalizador coñecido e comprobar que é posible levar a cabo este proceso. Ademais, estas técnicas contribuíron a ampliar o noso coñecemento sobre a estrutura das proteínas. Con todo, as características catalíticas destes exemplos obtidos non alcanzan o nivel de actividade das encimas naturais, polo xeral, teñen una capacidade de catálisis máis reducida [4].
En consecuencia, aínda que hai moito que mellorar, o deseño de novos biocatalizadores permítenos controlar a velocidade de calquera proceso do noso interese. Estas técnicas permiten que os procesos industriais realícense a temperaturas inferiores, sen necesidade de disolventes orgánicos, con mellor eficiencia, con menos auga e con menos residuos contaminantes. Por tanto, podemos deseñar os nanombres da vida para que os procesos industriais sexan compatibles coa vida.
Bibliografía
[1] Albert L. Lehninger, David L. Nelson e Michael M. Cox. Fundamentos de Bioquímica (2008), Universidade do País Vasco, 1ª edición.
[2] Po-Ssu Huang, Scott E. Boyken e David Baker. - Nature (2016), 537 (7620):320-7.
[3] Karlheinz Drauz, Harald Gröger e Oliver May. Enzyme catalysis in organic synthesis (2012), Wiley-VCH.
[4] Kiss G, Çelebi-Ölçüm N, Moretti R, Baker D, Houk KN. Computational enzyme design. Angewandte Chemie International Edition in English (2013), 52(22):5700-25.





