Buraco da capa de ozono
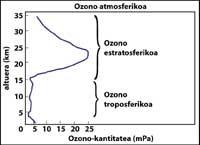
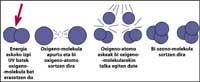
A capa de ozono atópase na estratosfera, entre 15 e 35 km, rodeando todo o planeta. A capa de ozono está formada por moléculas de gas de ozono. Cada molécula de ozono está formada por tres átomos de osíxeno de carácter inestable. Hai que lembrar que as moléculas de osíxeno están formadas por dous átomos de osíxeno. A molécula de ozono actúa como filtro paira a radiación ultravioleta denominada B, é dicir, entre 280 e 320 nanómetros (denominada en inglés UV-B). As radiacións UV-B son nocivas paira os animais e as plantas do planeta e, por suposto, tamén paira o ser humano.
Con todo, a radiación ultravioleta é imprescindible paira a formación de ozono, xa que a radiación ultravioleta libera moléculas de osíxeno. Estes reaccionan con outras moléculas de osíxeno paira formar ozono.
Efectos da radiación UV-B e ozono no ser humano
A falta de ozono estratosférico é prexudicial paira os animais e plantas do planeta. Pero a presenza de ozono a nivel da superficie terrestre tamén é prexudicial. Isto débese a que o ozono é inestable, polo que reacciona facilmente con outros elementos químicos. O ozono dificulta a respiración, especialmente aos seres humanos con asma, e causa danos en árbores e colleitas. Os científicos aínda non aclararon como se pode producir un gas inestable como o ozono a nivel da superficie terrestre, nin por que ocorre sobre todo na contorna das grandes cidades. Os seus habitantes xa están afeitos ás ‘alarmas de ozono’ como a capital chilena, Santiago de Compostela.
Contaminación humana ou contaminación natural?
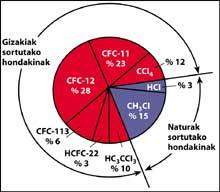
Está claro que o cloro (Cl) chegou á estratosfera, pero débese á contaminación humana ou chegou á estratosfera espontaneamente? De feito, na superficie terrestre pódense atopar grandes cantidades de cloro, como en forma de sal mariño (NaCl).
Cando a auga do mar se evapora tamén se evapora una cantidade de sal, pero volve ao chan con choiva, xeo ou neve, porque é soluble en auga. Outro lugar onde se pode atopar cloro en grandes cantidades son as piscinas, pero este cloro tamén é soluble en auga, polo que non presenta problemas.
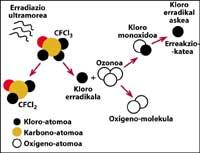
Una das fontes de contaminación natural son os volcáns, que arroxan cloruro de hidróxeno á atmosfera, pero o cloro convértese en ácido clorhídico, soluble en auga. Con todo, os halocarbonos utilizados polo ser humano, os CFCs, o tetracloruro de carbono (CCI4) e o cloroformo de metilo (CH-CCI3) non son solubles en auga polo que non caen na Terra con choiva, xeo ou neve. Por iso, chegan á estratosfera acompañados de vento. Tendo en conta isto, é evidente que o cloro estratosférico que destrúe o ozono é producido polo ser humano.
Como se destrúe a capa de ozono?
Está totalmente demostrado que o cloro destrúe o ozono. Este proceso prodúcese cando a radiación UV libera o átomo de cloro de CFC. O átomo de cloro reacciona e destrúe cunha molécula de ozono, pero tras a reacción o átomo de cloro permanece libre. Segue reaccionando e destruíndo outras moléculas de ozono. Este proceso é totalmente nocivo xa que una molécula de cloro pode destruír preto de 100.000 moléculas de ozono. Este proceso queda cando o cloro se combina con outro elemento. A vida media dun átomo de cloro na estratosfera é duns dous anos.
Pero é sabido que esta reacción se produce na estratosfera e que una molécula de CFC ten máis peso que o aire, entón como é posible que una molécula de CFC chegue á estratosfera? Isto débese a que o vento sempre está en movemento e mestura as sustancias químicas presentes no vento. Esta mestura e movemento sobe a molécula de CFC cunha forza maior da que caería co seu peso. Ademais, a molécula CFC non reacciona a nivel da Terra nin se disolve na auga, polo que a molécula CFC é facilmente alcanzable co seu peso na estratosfera.
Por que se utilizaron os CFCs?
Una vez lida a pregunta anterior, a calquera se lle ocorre a outra. Os CFCs foron creados polos químicos de General Motors na década de 1920. O uso de CFCs foi moi amplo e empregáronse en moitas industrias. A razón é que conseguir CFC era bastante barato. Ademais, cabe destacar a súa estabilidade, xa que as probas realizadas demostraron que non reaccionaba con outras moléculas. A isto hai que engadir que non era nocivo como ser. Ademais, non se disolve na auga. Con todo, ninguén pensou o que ía pasar cando esta molécula chegou á estratosfera.
Por que nos polos?
Está claro que a contaminación non se produce nos polos, senón a miles de quilómetros de alí. Por iso, parece moi raro que os efectos da contaminación prodúzanse nos polos. Pero este feito ten razón.
Os CFCs prodúcense e liberan principalmente no hemisferio norte. En concreto, o 90% dos CFCs do mundo prodúcense na antiga Unión Soviética, Xapón, Europa e EEUU.
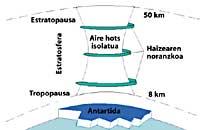
A continuación, os CFCs soben á estratosfera utilizando correntes de aire nos trópicos. Una vez na estratosfera, chegan a ambos polos aproveitando os ventos. Por iso, os CFCs esténdense por toda a atmosfera. Pero hai una diferenza entre ambos polos: a meteorología. A diferenza meteorolóxica baséase na superficie terrestre polar, xa que o Polo sur é una gran superficie de terreo rodeado de mar, mentres que o Polo norte ten una menor superficie terrestre e o mar que o rodea ten grandes extensións de terra, como as illas do norte de Canadá, Groenlandia, Escandinavia...
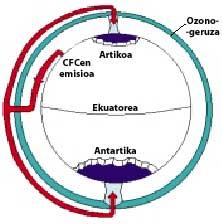
A meteorología do polo sur produce temperaturas frescas. Nos seis meses de verán hai luz 24 horas ao día e o ozono absorbe os raios UV. Isto provoca un lixeiro aumento da temperatura. Con todo, durante os seis meses de inverno o aire arrefríase lixeiramente, polo que baixa o aire e comeza a virar sobre a Antártida. A velocidade do aire ascende até os 400 km/h paira a primavera. Este remolino giratorio mantén o aire interior, polo que non hai confusión co aire exterior. Até aquí non hai diferenzas entre a Antártida e o Ártico. Pero no Ártico leste remolino de aire rompe varias veces debido ás terras mencionadas. En consecuencia, o aire interior do remolino mestúrase co exterior.
Na Antártida, pola contra, este remolino non ten obstáculos e a temperatura Ártica é 10 ou 15 veces menor que no inverno, é dicir, ao redor de 80 C baixo cero. Na primavera antártica, cos primeiros raios solares, a estratosfera comeza a quentarse e a diminuír a forza do remolino de aire. Paira mediados de novembro este remolino desaparece completamente. Con todo, a temperaturas frías anteriores, o ácido nítrico produce néboas estratosféricas de xeo, o que provoca un ambiente químico favorable paira a destrución do ozono.
Nestas néboas, HCl e CLONO 2 reaccionan entre si formando acedo nítrico e cloro (Cl 2). Esta molécula, en principio, é estable e non reacciona co ozono, pero os raios solares o fotolizan e descomponse en dous cloro radicais libres que reaccionan co ozono. No Polo norte as temperaturas máis altas reducen a xeración de néboas e por tanto a destrución de ozono.
Aumentará o buraco da capa de ozono?
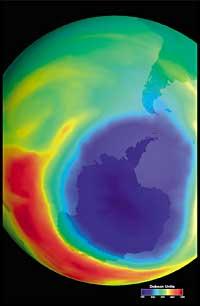
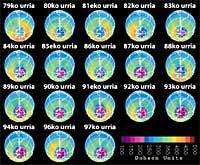
Ultimamente houbo un temor: se o buraco da capa de ozono chegará a Sudamérica, a terra máis próxima á Antártida. Pero antes de responder hai que saber que se considera un buraco paira Sudamérica. Os expertos chámanlle buraco cando en Sudamérica a columna de ozono é menor de 220 DU (Dobson unit). Tendo en conta isto, pódese afirmar que o buraco de ozono chegou a Sudamérica. De feito, no sur de Chile tivéronse medidas inferiores a 220 UD. Pero isto só ocorreu entre setembro e outubro, e só durante uns poucos días. Por tanto, a aresta suramericana pode considerarse como o límite do buraco da capa de ozono.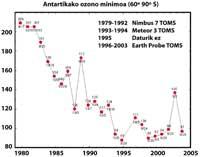
Os científicos están esperanzados de face ao futuro. De feito, os CFCs están prohibidos desde a firma do protocolo de Montreal (1987). Tendo en conta os estudos realizados, espérase que dentro de 50 anos desaparezan os CFCs, recuperando así o equilibrio natural do ozono.
Pero todos estes datos deben tomarse con moita cautela, xa que se pensaba que no ano 2000 o buraco da capa de ozono alcanzou a maior extensión da historia e que nos anos seguintes non se incrementou. Na natureza, con todo, hai moitos elementos a ter en conta, como é o caso de que en 2002 non se apreciase ningún buraco aparente debido á calor do ano, pero en 2003 apareceu coa súa extensión habitual, sendo o segundo máis grande coñecido.
Con todo, é certo que a concentración troposférica de sustancias nocivas paira o ozono está a diminuír desde 1995. Pero as sustancias nocivas necesitan entre tres e seis anos paira pasar da troposfera á estratosfera. Nos últimos anos a concentración de cloro na estratosfera permaneceu constante e comezou a descender lixeiramente. O futuro do ozono, con todo, non só depende do cloro, senón tamén doutras sustancias utilizadas polo home (metano, óxido nitroso, partículas de sulfato). E o cambio climático.

En resumo, pode dicirse que entre as sustancias presentes na atmosfera danse procesos moi complexos e que é difícil ter en conta todas as variables que interveñen paira detectar que ocorrerá no futuro. Pero os datos que temos son esperanzadores, parece que a destrución de ozono hase estancado e vai mellorar aos poucos. Con todo, está claro que a atmosfera futura non será a mesma que a que existía antes da década de 1970, e as sustancias atmosféricas deberán ser analizadas con cautela.
Danos á radiación ultravioleta Na actualidade está demostrado que, ademais de probas claras e precisas, o aumento da radiación UV-B ten efectos prexudiciais paira o ser humano:
|
Como se mide o ozono?
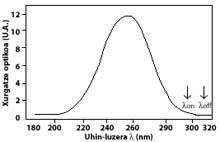
A técnica máis utilizada é a de absorción diferencial. A técnica consiste en medir a radiación de dúas ondas que chegan do sol á superficie terrestre. A lonxitude de onda destas dúas ondas é moi similar, pero nesas lonxitudes de onda a atenuación do ozono é moi diferente.
En concreto, a lambda on SUB off é de 315 nanómetros, onde a absorción da sección efectiva de ozono é varias veces maior que a de lambda on en lambda off. Ademais, a atenuación das radiacións solares doutros compoñentes presentes na atmosfera nesta parte do espectro é moi similar, polo que a división entre a irradiación de dúas lonxitudes de onda dá conta da cantidade de ozono.
En concreto, pódese dicir que si chamamos I lambda á radiación solar dunha determinada lonxitude de onda que chega á Terra, o seu valor é:

onde,
- L a lonxitude da atmosfera atravesada. Irradiación solar I ou lambda fóra da atmosfera. Coeficiente de atenuación debido aos compoñentes atmosféricos K ab lambda (vapor de auga, ozono, N 2 , 0 2 , CO 2 ...). k Coeficiente de atenuación debido á dispersión A lambda Rayleigh.
- Coeficiente de atenuación debido á dispersión k M lambda Mie.
Paira lonxitudes de onda ao redor de lambda on e lambda off, o valor dos coeficientes Rayleigh e Mie pode considerarse igual, é dicir, k A lambda on = k A lambda off e k M lambda on = k M lambda off. Así mesmo, nesta zona do espectro, a absorción dos compoñentes atmosféricos é despreciable, a excepción do ozono. Por tanto, a atenuación que sofre a luz solar nesta zona do espectro débese unicamente ao ozono estratosférico. É habitual que lambda on = 300 nm e lambda off = 315 nm e k ou lambda on = 7 ko lambda off, é dicir, a absorción de lambda on é sete veces maior que a de lambda off. En consecuencia, o coeficiente de intensidade de lambda on e lambda off obtense como:
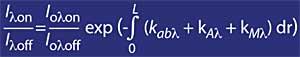
Se o coeficiente de absorción de ozono defínese mediante k ou lambda , a concentración de ozono (N) e a súa sección de absorción eficaz (T), a expresión anterior queda como segue:
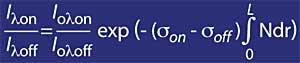
Pero hai que ter en conta o aire, paira iso utilizarase mr, onde mr é a masa relativa do aire. Cabe destacar que o factor mr corríxese en función da hora solar, o día do ano e a latitude para que sexa fiable.

onde,
- se D é a anchura media da capa de ozono.
- N é a concentración media da capa de ozono.
En consecuencia, explicouse como coñecendo as medidas I lambda on e I lambda off pódese coñecer a cantidade de ozono.
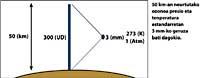
As frechas da imaxe da esquerda indican onde se realiza a absorción diferencial. Lambda on = 300 nm e lambda off = 315 nm, onde a eficacia de absorción do ozono é varias veces maior que a lambda on en lambda off.
Ademais, hai que ter en conta onde estamos e que día do ano é paira saber se o resultado da medida de ozono é alto ou baixo.
Historia do buraco da capa de ozono
Descubriuse por primeira vez en 1982 cando se estaba eliminando a capa de ozono, cando se deron a coñecer os datos da columna de ozono medida pola estación xaponesa Syowa (69H, 39E), situada na Antártida. As medicións comezaron en 1964 e demostraban que a partir de 1975 o ozono tiña una clara tendencia á baixa.
No resto de estacións dispersas pola Antártida observouse un comportamento similar ao ozono, e en todas elas a diminución do ozono comezou nos anos 70. Ademais, os científicos descubriron que a diminución do ozono comezaba na primavera austral e desaparecía a toda velocidade. Os científicos do mundo angustiáronse porque se o proceso seguise adiante poderían ter consecuencias graves paira o home e o planeta.
Anos despois, J deu un paso importante paira entender o que se coñecía como o buraco da capa de ozono. Lovelock. De feito, o científico inglés embarcouse nun proxecto que tiña como obxectivo estudar a dinámica que se producía na alta atmosfera. Paira iso, centrouse naquelas sustancias emitidas á atmosfera con gran frecuencia que tiñan una longa vida antes da súa destrución. Así, seguindo as pegadas destas sustancias, descubriu como chegaron á Antártida desde os lugares onde se formaban.
Chamou marcadores a aquelas sustancias que ía utilizar paira coñecer o comportamento da atmosfera. Tras analizar diversas sustancias, seleccionou os CFCs paira este traballo, debido ao seu uso e estabilidade. Mentres seguía a pegada dos CFC, deuse conta de que estaban en alta concentración na Antártida.
Considerábase que os CFCs eran moi estables e que non afectaban a nada, por iso utilizábanse tantas industrias totalmente diferentes e paira moitos propósitos. Pero Molina e Rowland demostraron en 1972 que nos CFCs a irradiación ultravioleta liberaba cloro que destruía ozono.
Cando se coñeceu todo iso, os grupos ecoloxistas iniciaron campañas contra os CFCs paira concienciar á xente. Desta forma, ampliouse a postura contra os CFCs. Os políticos, ante a gravidade da situación, apoiaron a prohibición dos CFCs en varias conferencias, sempre con máis lentitude do desexado polos ecoloxistas e máis rápido do desexado pola industria química.
Falouse por primeira vez na Conferencia sobre o Medio Humano sobre a capa de ozono celebrada en Estocolmo (1972). En 1977 os expertos reuníronse en Washington paira levar a cabo o Plan Mundial da Capa de Ozono. Catro anos despois, as Nacións Unidas propuxeron un tratado sobre o problema da capa de ozono. O primeiro acordo internacional asinouse en Viena en 1985, onde se expuxo a intención de investigar as consecuencias da falta de capa de ozono.
Pero o convenio máis coñecido é o asinado en 1987 en Montreal. Foi asinado por 165 países, que aglutinaron o 90% da produción mundial, e o seu obxectivo era acabar coas sustancias destrutoras do ozono. Paira iso estableceron dúas datas: 1996 paira os pobos desenvolvidos e 2010 paira outros pobos. Co obxectivo de reforzar este acordo alcanzouse un acordo de reunirse polo menos cada catro anos. As máis importantes foron Viena (1995) e Montreal (1997). Na actualidade 180 países asinaron o convenio de Montreal.
Bibliografía
- Ciencias da natureza Vol. 12, Planeta (1997). Como funciona a natureza Debate (1992). Uriarte, A. Ozono: a catástrofe que non chega Terceira Prensa (1995). Cacho, J. e Sainz de Aja, J. Antártida: o buraco de ozono. Tabapress (1989).