Trou de couche d'ozone
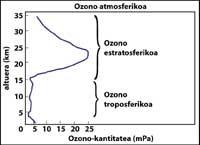
La couche d'ozone se trouve dans la stratosphère, entre 15 et 35 km, autour de la planète. La couche d'ozone est formée de molécules de gaz d'ozone. Chaque molécule d'ozone est formée de trois atomes d'oxygène de caractère instable. Rappelons que les molécules d'oxygène sont constituées de deux atomes d'oxygène. La molécule d'ozone agit comme un filtre pour le rayonnement ultraviolet appelé B, c'est-à-dire entre 280 et 320 nanomètres (appelé en anglais UV-B). Les radiations UV-B sont nocives pour les animaux et les plantes de la planète et, bien sûr, aussi pour l'être humain.
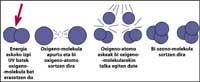
Cependant, le rayonnement ultraviolet est indispensable pour la formation d'ozone, car le rayonnement ultraviolet libère des molécules d'oxygène. Ils réagissent avec d'autres molécules d'oxygène pour former de l'ozone.
Effets du rayonnement UV-B et de l'ozone chez l'homme
Le manque d'ozone stratosphérique est préjudiciable aux animaux et aux plantes de la planète. Mais la présence d'ozone au niveau de la surface terrestre est également préjudiciable. C'est parce que l'ozone est instable, donc il réagit facilement avec d'autres éléments chimiques. L'ozone empêche la respiration, en particulier les humains d'asthme, et cause des dommages aux arbres et aux récoltes. Les scientifiques n'ont pas encore précisé comment un gaz instable comme l'ozone peut se produire au niveau de la surface terrestre, ni pourquoi il se produit surtout dans l'environnement des grandes villes. Ses habitants sont déjà habitués aux ‘alarmes d’ozone’ comme la capitale chilienne, Santiago de Compostela.
Pollution humaine ou pollution naturelle ?
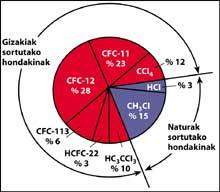
Il est clair que le chlore (Cl) est arrivé dans la stratosphère, mais est-il dû à la pollution humaine ou est-il arrivé dans la stratosphère spontanément? En fait, de grandes quantités de chlore peuvent être trouvées sur la surface terrestre, comme sous forme de sel marin (NaCl).
Lorsque l'eau de mer s'évapore, une quantité de sel s'évapore, mais revient au sol avec de la pluie, de la glace ou de la neige, car elle est soluble dans l'eau. Un autre endroit où vous pouvez trouver du chlore en grandes quantités sont les piscines, mais ce chlore est également soluble dans l'eau, donc il ne présente pas de problèmes.
Une des sources de pollution naturelle sont les volcans, qui jettent du chlorure d'hydrogène dans l'atmosphère, mais le chlore devient acide chlorhydique, soluble dans l'eau. Cependant, les halogénures utilisés par l'être humain, les CFC, le tétraclorure de carbone (CCI4) et le chloroforme de méthyle (CH-CCI3) ne sont pas solubles dans l'eau de sorte qu'ils ne tombent pas sur Terre avec de la pluie, de la glace ou de la neige. C'est pourquoi ils arrivent dans la stratosphère accompagnés de vent. Compte tenu de cela, il est évident que le chlore stratosphérique qui détruit l'ozone est produit par l'être humain.
Comment la couche d'ozone est-elle détruite ?
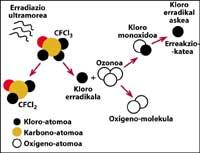
Il est démontré que le chlore détruit l'ozone. Ce processus se produit lorsque le rayonnement UV libère l'atome de chlore de CFC. L'atome de chlore réagit et détruit avec une molécule d'ozone, mais après la réaction l'atome de chlore reste libre. Il continue de réagir et de détruire d'autres molécules d'ozone. Ce processus est totalement nocif car une molécule de chlore peut détruire environ 100.000 molécules d'ozone. Ce processus reste lorsque le chlore est combiné avec un autre élément. La demi-vie d'un atome de chlore dans la stratosphère est d'environ deux ans.
Mais on sait que cette réaction se produit dans la stratosphère et qu'une molécule de CFC a plus de poids que l'air, alors comment est-il possible qu'une molécule de CFC atteigne la stratosphère ? C'est parce que le vent est toujours en mouvement et mélange les substances chimiques présentes dans le vent. Ce mélange et mouvement augmente la molécule de CFC avec une force plus grande que celle qui tomberait avec son poids. En outre, la molécule CFC ne réagit pas au niveau de la Terre ni ne se dissout dans l'eau, de sorte que la molécule CFC est facilement réalisable avec son poids dans la stratosphère.
Pourquoi les CFC ont-ils été utilisés ?
Une fois que vous avez lu la question précédente, l'autre se produit. Les CFC ont été créés par les chimistes de General Motors dans les années 1920. L'utilisation de CFC a été très large et a été utilisée dans de nombreuses industries. La raison est que l'obtention de CFC était assez bon marché. En outre, il convient de souligner sa stabilité, car les tests effectués ont montré qu'il ne réagissait pas avec d'autres molécules. A cela il faut ajouter que ce n'était pas nocif comme être. En outre, il ne se dissout pas dans l'eau. Cependant, personne n'a pensé ce qui allait arriver quand cette molécule a atteint la stratosphère.
Pourquoi dans les pôles ?
Il est clair que la pollution ne se produit pas dans les pôles, mais à des milliers de kilomètres de là. Par conséquent, il semble très rare que les effets de la pollution se produisent dans les pôles. Mais ce fait a raison.
Les CFC sont produits et libérés principalement dans l'hémisphère nord. Plus précisément, 90% des CFC du monde sont produits dans l'ex-Union soviétique, le Japon, l'Europe et les États-Unis.
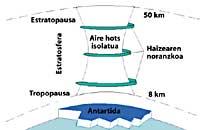
Ensuite, les CFC montent dans la stratosphère en utilisant des courants d'air dans les tropiques. Une fois dans la stratosphère, ils arrivent aux deux pôles en profitant des vents. C'est pourquoi les CFC s'étendent dans toute l'atmosphère. Mais il y a une différence entre les deux pôles : la météorologie. La différence météorologique est basée sur la surface terrestre polaire, puisque le pôle Sud est une grande surface de terrain entourée de mer, tandis que le pôle Nord a une surface terrestre inférieure et la mer qui l'entoure a de grandes étendues de terre, comme les îles du nord du Canada, le Groenland, la Scandinavie...
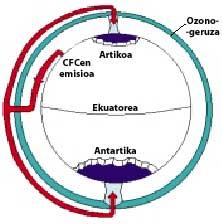
La météorologie du pôle sud produit des températures fraîches. Pendant les six mois d'été, la lumière est 24 heures par jour et l'ozone absorbe les rayons UV. Cela provoque une légère augmentation de la température. Cependant, pendant les six mois d'hiver l'air refroidit légèrement, de sorte que l'air descend et commence à tourner sur l'Antarctique. La vitesse de l'air atteint 400 km/h au printemps. Ce tourbillon rotatif maintient l'air intérieur, il n'y a donc pas de confusion avec l'air extérieur. Jusqu'ici, il n'y a aucune différence entre l'Antarctique et l'Arctique. Mais dans l'Arctique ce tourbillon d'air se brise plusieurs fois en raison des terres mentionnées. Par conséquent, l'air intérieur du tourbillon est mélangé avec l'extérieur.
En Antarctique, au contraire, ce tourbillon n'a pas d'obstacles et la température arctique est 10 ou 15 fois inférieure à l'hiver, soit environ 80 C sous zéro. Au printemps antarctique, avec les premiers rayons solaires, la stratosphère commence à chauffer et à diminuer la force du tourbillon d'air. À la mi-novembre, ce tourbillon disparaît complètement. Cependant, à des températures froides antérieures, l'acide nitrique produit des brouillards stratosphériques de glace, ce qui provoque un environnement chimique favorable à la destruction de l'ozone.
Dans ces brouillards, HCl et ClONO 2 réagissent entre eux en formant de l'acide nitrique et du chlore (Cl 2). Cette molécule, en principe, est stable et ne réagit pas avec l'ozone, mais les rayons solaires le photolitent et se décompose en deux chlore radicaux libres qui réagissent avec l'ozone. Au pôle Nord, les températures plus élevées réduisent la production de brouillards et donc la destruction d'ozone.
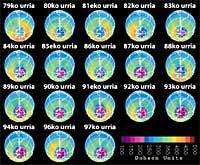
Augmentera-t-il le trou de la couche d'ozone ?
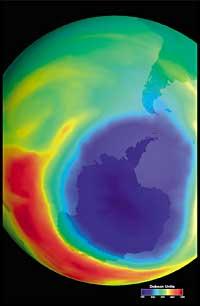
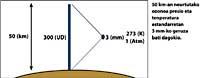
Dernièrement, il y a eu une peur : si le trou de la couche d'ozone arrivera en Amérique du Sud, la terre la plus proche de l'Antarctique. Mais avant de répondre, il faut savoir ce qui est considéré comme un trou pour l'Amérique du Sud. Les experts l'appellent trou quand en Amérique du Sud la colonne d'ozone est inférieure à 220 DU (Dobson unit). Compte tenu de cela, on peut affirmer que le trou d'ozone est arrivé en Amérique du Sud. En fait, dans le sud du Chili ont eu des mesures inférieures à 220 UD. Mais cela ne s'est produit qu'entre septembre et octobre, et seulement pendant quelques jours. L'arête sud-américaine peut donc être considérée comme la limite du trou de la couche d'ozone.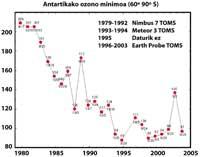
Les scientifiques s'attendent à l'avenir. En fait, les CFC sont interdits depuis la signature du protocole de Montréal (1987). Compte tenu des études menées, les CFC devraient disparaître dans les 50 ans, et ainsi retrouver l'équilibre naturel de l'ozone.
Mais toutes ces données doivent être prises avec beaucoup de prudence, car on pensait qu'en 2000 le trou de la couche d'ozone a atteint la plus grande étendue de l'histoire et qu'il n'aurait pas été augmenté dans les années suivantes. Dans la nature, cependant, il y a beaucoup d'éléments à prendre en compte, comme c'est le cas en 2002 qu'aucun trou apparent n'a été apprécié en raison de la chaleur de l'année, mais en 2003 il est apparu avec son extension habituelle, étant le deuxième plus grand connu.
Cependant, il est vrai que la concentration troposphérique de substances nocives pour l'ozone diminue depuis 1995. Mais les substances nocives ont besoin de trois à six ans pour passer de la troposphère à la stratosphère. Ces dernières années, la concentration du chlore dans la stratosphère est restée constante et a commencé à descendre légèrement. L'avenir de l'ozone dépend non seulement du chlore, mais aussi d'autres substances utilisées par l'homme (méthane, oxyde nitreux, particules de sulfate). Et le changement climatique.

En résumé, on peut dire qu'entre les substances présentes dans l'atmosphère se produisent des processus très complexes et qu'il est difficile de tenir compte de toutes les variables qui interviennent pour détecter ce qui se passera dans l'avenir. Mais les données que nous avons sont encourageantes, il semble que la destruction de l'ozone a stagné et va s'améliorer progressivement. Cependant, il est clair que l'atmosphère future ne sera pas la même que celle qui existait avant les années 1970, et les substances atmosphériques devront être analysées avec prudence.
Dommages aux rayons ultraviolets Il est actuellement prouvé que, en plus de preuves claires et précises, l'augmentation du rayonnement UV-B a des effets néfastes pour l'être humain:
|
Comment mesurer l'ozone ?
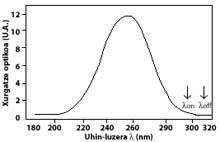
La technique la plus utilisée est celle d'absorption différentielle. La technique consiste à mesurer le rayonnement de deux ondes venant du soleil à la surface terrestre. La longueur d'onde de ces deux ondes est très similaire, mais dans ces longueurs d'onde l'atténuation de l'ozone est très différente.
Plus précisément, la lambda on SUB off est de 315 nanomètres, où l'absorption de la section efficace de l'ozone est plusieurs fois supérieure à celle de lambda on en lambda off. En outre, l'atténuation des radiations solaires d'autres composants présents dans l'atmosphère dans cette partie du spectre est très similaire, de sorte que la division entre le rayonnement à deux longueurs d'onde rend compte de la quantité d'ozone.
En particulier, on peut dire que si on appelle I lambda au rayonnement solaire d'une certaine longueur d'onde qui atteint la Terre, sa valeur est:

où,
- L la longueur de l'atmosphère traversée. Rayonnement solaire I ou lambda hors de l'atmosphère. Coefficient d'atténuation dû aux composants atmosphériques K ab lambda (vapeur d'eau, ozone, N 2 , 0 2 , CO 2 ...). k Coefficient d'atténuation en raison de la dispersion A lambda Rayleigh.
- Coefficient d'atténuation dû à la dispersion k M lambda Mie.
Pour les longueurs d'onde autour de lambda on et lambda off, la valeur des coefficients Rayleigh et Mie peut être considérée comme égale, c'est-à-dire k A lambda on = k A lambda off et k M lambda on = k M lambda off. De même, dans cette zone du spectre, l'absorption des composants atmosphériques est négligeable, à l'exception de l'ozone. L'atténuation de la lumière du soleil dans cette zone du spectre est donc uniquement due à l'ozone stratosphérique. Il est courant que lambda on = 300 nm et lambda off = 315 nm et k ou lambda on = 7 ko lambda off, c'est-à-dire que l'absorption de lambda on est sept fois supérieure à celle de lambda off. Par conséquent, le coefficient d'intensité lambda on et lambda off est obtenu comme:
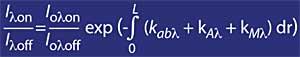
Si le coefficient d'absorption d'ozone est défini par k ou lambda , la concentration d'ozone (N) et sa section d'absorption efficace (T), l'expression ci-dessus est la suivante:
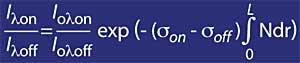
Mais il faut tenir compte de l'air, pour cela on utilisera mr, où mr est la masse relative de l'air. Il convient de noter que le facteur mr est corrigé en fonction de l'heure solaire, le jour de l'année et la latitude pour être fiable.

où,
- si D est la largeur moyenne de la couche d'ozone.
- N est la concentration moyenne de la couche d'ozone.
En conséquence, on a expliqué comment connaître les mesures I lambda on et I lambda off on peut connaître la quantité d'ozone.
Les flèches de l'image de gauche indiquent où l'absorption différentielle est effectuée. Lambda on = 300 nm et lambda off = 315 nm, où l'efficacité d'absorption de l'ozone est plusieurs fois supérieure à la lambda on en lambda off.
En outre, il faut prendre en compte où nous sommes et quel jour de l'année est pour savoir si le résultat de la mesure d'ozone est haut ou bas.
Histoire du trou de la couche d'ozone
Elle a été découverte pour la première fois en 1982 lorsque la couche d'ozone était éliminée, lorsque les données de la colonne d'ozone mesurée par la station japonaise Syowa (69H, 39E), située en Antarctique ont été divulguées. Les mesures ont commencé en 1964 et ont montré qu'à partir de 1975 l'ozone avait une nette tendance à la baisse.
Dans les autres stations dispersées dans l'Antarctique, un comportement similaire à l'ozone a été observé et la diminution de l'ozone a commencé dans les années 70. En outre, les scientifiques ont découvert que la diminution de l'ozone commençait au printemps austral et disparaissait à toute vitesse. Les scientifiques du monde ont été accablés parce que si le processus continue, il pourrait avoir des conséquences graves pour l'homme et la planète.
Des années plus tard, J a fait un pas important pour comprendre ce qui était connu comme le trou de la couche d'ozone. Lovelock. En fait, le scientifique anglais a entrepris un projet visant à étudier la dynamique qui se produisait dans la haute atmosphère. Pour ce faire, il s'est concentré sur les substances émises dans l'atmosphère très souvent qui avaient une longue vie avant leur destruction. Ainsi, sur les traces de ces substances, il découvrit comment ils arrivèrent en Antarctique depuis les lieux où ils se formaient.
Il a appelé marqueurs à ces substances qu'il utiliserait pour connaître le comportement de l'atmosphère. Après avoir analysé diverses substances, il a sélectionné les CFC pour ce travail en raison de leur utilisation et de leur stabilité. Tout en suivant l'empreinte des CFC, il a réalisé qu'ils étaient en forte concentration en Antarctique.
On considérait que les CFC étaient très stables et n'affectaient rien, c'est pourquoi on utilisait tant d'industries totalement différentes et à bien des fins. Mais Molina et Rowland ont montré en 1972 que dans les CFC le rayonnement ultraviolet libérait du chlore détruisant l'ozone.
Quand tout cela a été connu, les groupes écologistes ont lancé des campagnes contre les CFC pour sensibiliser les gens. Ainsi, la position contre les CFC a été élargie. Les politiciens, face à la gravité de la situation, ont soutenu l'interdiction des CFC lors de plusieurs conférences, toujours plus lents que souhaités par les écologistes et plus rapides que souhaités par l'industrie chimique.
On a parlé pour la première fois à la Conférence sur le milieu humain sur la couche d'ozone tenue à Stockholm (1972). En 1977, les experts se sont réunis à Washington pour réaliser le Plan mondial de la couche d'ozone. Quatre ans plus tard, l'ONU a proposé un traité sur le problème de la couche d'ozone. Le premier accord international a été signé à Vienne en 1985, où l'intention était d'enquêter sur les conséquences du manque de couche d'ozone.
Mais l'accord le plus connu est celui signé en 1987 à Montréal. Elle a été signée par 165 pays, qui ont rassemblé 90% de la production mondiale, et vise à mettre fin aux substances destructrices de l'ozone. Pour cela, ils ont établi deux dates: 1996 pour les peuples développés et 2010 pour les autres peuples. Afin de renforcer cet accord, un accord a été conclu pour se réunir au moins tous les quatre ans. Les plus importantes ont été Vienne (1995) et Montréal (1997). Actuellement, 180 pays ont signé la convention de Montréal.
Bibliographie Bibliographie
- Sciences de la nature Vol. 12, Planète (1997). Comment fonctionne la nature Débat (1992). Uriarte, A. Ozone: la catastrophe qui n'arrive pas Troisième Presse (1995). Cacho, J. et Sainz de Aja, J. Antarctique: le trou d'ozone. Tabapress (1989).