Forat de la capa d'ozó
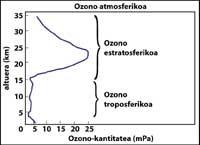
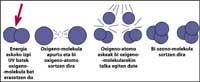
La capa d'ozó es troba en l'estratosfera, entre 15 i 35 km, envoltant tot el planeta. La capa d'ozó està formada per molècules de gas d'ozó. Cada molècula d'ozó està formada per tres àtoms d'oxigen de caràcter inestable. Cal recordar que les molècules d'oxigen estan formades per dos àtoms d'oxigen. La molècula d'ozó actua com a filtre per a la radiació ultraviolada denominada B, és a dir, entre 280 i 320 nanòmetres (denominada en anglès UV-B). Les radiacions UV-B són nocives per als animals i les plantes del planeta i, per descomptat, també per a l'ésser humà.
No obstant això, la radiació ultraviolada és imprescindible per a la formació d'ozó, ja que la radiació ultraviolada allibera molècules d'oxigen. Aquests reaccionen amb altres molècules d'oxigen per a formar ozó.
Efectes de la radiació UV-B i ozó en l'ésser humà
La falta d'ozó estratosfèric és perjudicial per als animals i plantes del planeta. Però la presència d'ozó a nivell de la superfície terrestre també és perjudicial. Això es deu al fet que l'ozó és inestable, per la qual cosa reacciona fàcilment amb altres elements químics. L'ozó dificulta la respiració, especialment als éssers humans amb asma, i causa danys en arbres i collites. Els científics encara no han aclarit com es pot produir un gas inestable com l'ozó a nivell de la superfície terrestre, ni per què ocorre sobretot a l'entorn de les grans ciutats. Els seus habitants ja estan acostumats a les ‘alarmes d'ozó’ com la capital xilena, Santiago de Compostel·la.
Contaminació humana o contaminació natural?
És clar
que el clor (Cl) ha arribat a l'estratosfera, però es deu a la contaminació humana o ha arribat a l'estratosfera espontàniament? De fet, en la superfície terrestre es poden trobar grans quantitats de clor, com en forma de sal marina (NaCl).
Quan l'aigua de la mar s'evapora també s'evapora una quantitat de sal, però torna al sòl amb pluja, gel o neu, perquè és soluble en aigua. Un altre lloc on es pot trobar clor en grans quantitats són les piscines, però aquest clor també és soluble en aigua, per la qual cosa no presenta problemes.
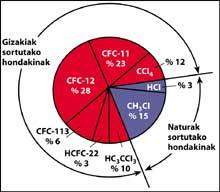
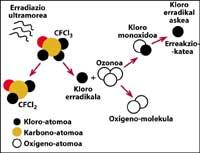
Una de les fonts de contaminació natural són els volcans, que llancen clorur d'hidrogen a l'atmosfera, però el clor es converteix en àcid clorhídico, soluble en aigua. No obstant això, els halocarbonos utilitzats per l'ésser humà, els CFCs, el tetraclorur de carboni (CCI4) i el cloroform de metil (CH-CCI3) no són solubles en aigua pel que no cauen en la Terra amb pluja, gel o neu. Per això, arriben a l'estratosfera acompanyats de vent. Tenint en compte això, és evident que el clor estratosfèric que destrueix l'ozó és produït per l'ésser humà.
Com es destrueix la capa d'ozó?
Està
totalment demostrat que el clor destrueix l'ozó. Aquest procés es produeix quan la radiació UV allibera l'àtom de clor de CFC. L'àtom de clor reacciona i destrueix amb una molècula d'ozó, però després de la reacció l'àtom de clor roman lliure. Continua reaccionant i destruint altres molècules d'ozó. Aquest procés és totalment nociu ja que una molècula de clor pot destruir prop de 100.000 molècules d'ozó. Aquest procés queda quan el clor es combina amb un altre element. La vida mitjana d'un àtom de clor en l'estratosfera és d'uns dos anys.
Però és sabut que aquesta reacció es produeix en l'estratosfera i que una molècula de CFC té més pes que l'aire, llavors com és possible que una molècula de CFC arribi a l'estratosfera? Això es deu al fet que el vent sempre està en moviment i mescla les substàncies químiques presents en el vent. Aquesta mescla i moviment puja la molècula de CFC amb una força major de la qual cauria amb el seu pes. A més, la molècula CFC no reacciona a nivell de la Terra ni es dissol en l'aigua, per la qual cosa la molècula CFC és fàcilment assolible amb el seu pes en l'estratosfera.
Per què es van utilitzar els CFCs?
Una vegada llegida la pregunta anterior, a qualsevol se li ocorre l'altra. Els CFCs van ser creats pels químics de General Motors en la dècada de 1920. L'ús de CFCs va ser molt ampli i es van emprar en moltes indústries. La raó és que aconseguir CFC era bastant barat. A més, cal destacar la seva estabilitat, ja que les proves realitzades van demostrar que no reaccionava amb altres molècules. A això cal afegir que no era nociu com ser. A més, no es dissol en l'aigua. No obstant això, ningú va pensar el que anava a passar quan aquesta molècula va arribar a l'estratosfera.
Per què en els pols?
És clar que la contaminació no es produeix en els pols, sinó a milers de quilòmetres d'allí. Per això, sembla molt estrany que els efectes de la contaminació es produeixin en els pols. Però aquest fet té raó.
Els CFCs es produeixen i alliberen principalment en l'hemisferi nord. En concret, el 90% dels CFCs del món es produeixen en l'antiga Unió Soviètica, el Japó, Europa i els EUA.
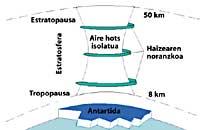
A continuació, els CFCs pugen a l'estratosfera utilitzant corrents d'aire en els tròpics. Una vegada en l'estratosfera, arriben a tots dos pols aprofitant els vents. Per això, els CFCs s'estenen per tota l'atmosfera. Però hi ha una diferència entre tots dos pols: la meteorologia. La diferència meteorològica es basa en la superfície terrestre polar, ja que el Pol Sud és una gran superfície de terreny envoltat de mar, mentre que el Pol Nord té una menor superfície terrestre i la mar que l'envolta té grans extensions de terra, com les illes del nord del Canadà, Groenlàndia, Escandinàvia...
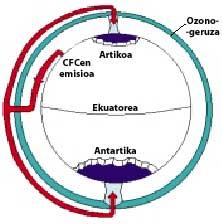
La meteorologia del pol sud produeix temperatures fresques. En els sis mesos d'estiu hi ha llum 24 hores al dia i l'ozó absorbeix els raigs UV. Això provoca un lleuger augment de la temperatura. No obstant això, durant els sis mesos d'hivern l'aire es refreda lleugerament, per la qual cosa baixa l'aire i comença a girar sobre l'Antàrtida. La velocitat de l'aire ascendeix fins als 400 km/h per a la primavera. Aquest remolí giratori manté l'aire interior, per la qual cosa no hi ha confusió amb l'aire exterior. Fins aquí no hi ha diferències entre l'Antàrtida i l'Àrtic. Però a l'Àrtic aquest remolí d'aire es trenca diverses vegades a causa de les terres esmentades. En conseqüència, l'aire interior del remolí es barreja amb l'exterior.
A l'Antàrtida, per contra, aquest remolí no té obstacles i la temperatura Àrtica és 10 o 15 vegades menor que a l'hivern, és a dir, al voltant de 80 C sota zero. En la primavera antàrtica, amb els primers raigs solars, l'estratosfera comença a escalfar-se i a disminuir la força del remolí d'aire. Per a mediats de novembre aquest remolí desapareix completament. No obstant això, a temperatures fredes anteriors, l'àcid nítric produeix boires estratosfèriques de gel, la qual cosa provoca un ambient químic favorable per a la destrucció de l'ozó.
En aquestes boires, HCl i Clono 2 reaccionen entre si formant àcid nítric i clor (Cl 2). Aquesta molècula, en principi, és estable i no reacciona amb l'ozó, però els raigs solars el fotolizan i es descompon en dos clor radicals lliures que reaccionen amb l'ozó. En el Pol Nord les temperatures més altes redueixen la generació de boires i per tant la destrucció d'ozó.
Augmentarà el forat de la capa d'ozó?
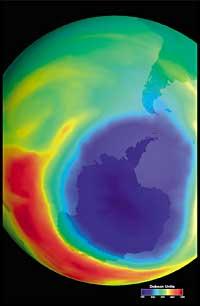
Últimament hi ha hagut un temor: si el forat de la capa d'ozó arribarà a Sud-amèrica, la terra més pròxima a l'Antàrtida. Però abans de respondre cal saber què es considera un forat per a Sud-amèrica. Els experts li diuen forat quan a Sud-amèrica la columna d'ozó és menor de 220 DU (Dobson unit). Tenint en compte això, es pot afirmar que el forat d'ozó ha arribat a Sud-amèrica. De fet, en el sud de Xile s'han tingut mesures inferiors a 220 UN. Però això només ha ocorregut entre setembre i octubre, i només durant uns pocs dies. Per tant, l'aresta sud-americana pot considerar-se com el límit del forat de la capa d'ozó.
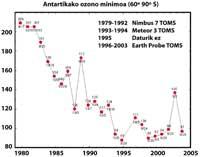
Els científics estan esperançats de cara al futur. De fet, els CFCs estan prohibits des de la signatura del protocol de Mont-real (1987). Tenint en compte els estudis realitzats, s'espera que dins de 50 anys desapareguin els CFCs, recuperant així l'equilibri natural de l'ozó.
Però totes aquestes dades han de prendre's amb molta cautela, ja que es pensava que l'any 2000 el forat de la capa d'ozó va aconseguir la major extensió de la història i que en els anys següents no s'hauria incrementat. En la naturalesa, no obstant això, hi ha molts elements a tenir en compte, com és el cas que en 2002 no s'apreciés cap forat aparent a causa de la calor de l'any, però en 2003 va aparèixer amb la seva extensió habitual, sent el segon més gran conegut.
No obstant això, és cert que la concentració troposfèrica de substàncies nocives per a l'ozó està disminuint des de 1995. Però les substàncies nocives necessiten entre tres i sis anys per a passar de la troposfera a l'estratosfera. En els últims anys la concentració de clor en l'estratosfera ha romàs constant i ha començat a descendir lleugerament. El futur de l'ozó, no obstant això, no sols depèn del clor, sinó també d'altres substàncies utilitzades per l'home (metà, òxid nitrós, partícules de sulfat). I el canvi climàtic.

En resum, pot dir-se que entre les substàncies presents en l'atmosfera es donen processos molt complexos i que és difícil tenir en compte totes les variables que intervenen per a detectar què ocorrerà en el futur. Però les dades que tenim són esperançadors, sembla que la destrucció d'ozó s'ha estancat i millorarà a poc a poc. No obstant això, és clar que l'atmosfera futura no serà la mateixa que la que existia abans de la dècada de 1970, i les substàncies atmosfèriques hauran de ser analitzades amb cautela.
Danys a la radiació ultraviolada En l'actualitat està demostrat que, a més de proves clares i precises, l'augment de la radiació UV-B té efectes perjudicials per a l'ésser humà:
Afecta al sistema immunològic. Fa mal als ulls, per exemple, produeix cataractes. Aprofundeix en les cremades solars i envelleix la pell. Augmenta el risc de dermatitis al·lèrgica i tòxica. Enforteix algunes malalties de bacteris i virus. Redueix el rendiment de la pesca i les collites. |
Com es mesura l'ozó?
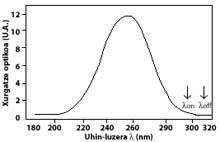
La tècnica més utilitzada és la d'absorció diferencial. La tècnica consisteix a mesurar la radiació de dues ones que arriben del sol a la superfície terrestre. La longitud d'ona d'aquestes dues ones és molt similar, però en aquestes longituds d'ona l'atenuació de l'ozó és molt diferent.
En concret, la lambda on SUB off és de 315 nanòmetres, on l'absorció de la secció efectiva d'ozó és diverses vegades major que la de lambda on en lambda off. A més, l'atenuació de les radiacions solars d'altres components presents en l'atmosfera en aquesta part de l'espectre és molt similar, per la qual cosa la divisió entre la irradiació de dues longituds d'ona dóna compte de la quantitat d'ozó.
En concret, es pot dir que si cridem I lambda a la radiació solar d'una determinada longitud d'ona que arriba a la Terra, el seu valor és:

on,
- L la longitud de l'atmosfera travessada.
- Coeficient d'atenuació a causa de la dispersió k M lambda Mie.
Irradiació solar I o lambda fora de l'atmosfera. Coeficient d'atenuació a causa dels components atmosfèrics
K ab lambda (vapor d'aigua, ozó, N 2 , 0 2 , CO 2 ...).
k Coeficient d'atenuació a causa de la dispersió A lambda Rayleigh.
Per a longituds d'ona al voltant de lambda on i lambda off, el valor dels coeficients Rayleigh i Mie pot considerar-se igual, és a dir, k A lambda on = k A lambda off i k M lambda on = k M lambda off. Així mateix, en aquesta zona de l'espectre, l'absorció dels components atmosfèrics és menyspreable, a excepció de l'ozó. Per tant, l'atenuació que sofreix la llum solar en aquesta zona de l'espectre es deu únicament a l'ozó estratosfèric. És habitual que lambda on = 300 nm i lambda off = 315 nm i k o lambda on = 7 ko lambda off, és a dir, l'absorció de lambda on és set vegades major que la de lambda off. En conseqüència, el coeficient d'intensitat de lambda on i lambda off s'obté com:
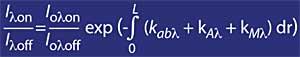
Si el coeficient d'absorció d'ozó es defineix mitjançant k o lambda , la concentració d'ozó (N) i la seva secció d'absorció eficaç (T), l'expressió anterior queda com segueix:
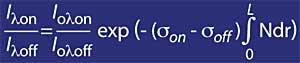
Però cal tenir en compte l'aire, per a això s'utilitzarà mr, on mr és la massa relativa de l'aire. Cal destacar que el factor mr es corregeix en funció de l'hora solar, el dia de l'any i la latitud perquè sigui fiable.

on,
- si D és l'amplària mitjana de la capa d'ozó.
- N és la concentració mitjana de la capa d'ozó.
En conseqüència, s'ha explicat com coneixent les mesures I lambda on i I lambda off es pot conèixer la quantitat d'ozó.
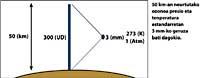
Les fletxes de la imatge de l'esquerra indiquen on es realitza l'absorció diferencial. Lambda on = 300 nm i lambda off = 315 nm, on l'eficàcia d'absorció de l'ozó és diverses vegades major que la lambda on en lambda off.
A més, cal tenir en compte on estem i quin dia de l'any és per a saber si el resultat de la mesura d'ozó és alt o baix.
Història del forat de la capa d'ozó
Es va descobrir per primera vegada en 1982 quan s'estava eliminant la capa d'ozó, quan es van donar a conèixer les dades de la columna d'ozó mesura per l'estació japonesa Syowa (69H, 39E), situada a l'Antàrtida. Els mesuraments van començar en 1964 i demostraven que a partir de 1975 l'ozó tenia una clara tendència a la baixa.
En la resta d'estacions disperses per l'Antàrtida es va observar un comportament similar a l'ozó, i en totes elles la disminució de l'ozó va començar en els anys 70. A més, els científics van descobrir que la disminució de l'ozó començava en la primavera austral i desapareixia a tota velocitat. Els científics del món es van atabalar perquè si el procés seguís endavant podrien tenir conseqüències greus per a l'home i el planeta.
Anys després, J va fer un pas important per a entendre el que es coneixia com el forat de la capa d'ozó. Lovelock. De fet, el científic anglès es va embarcar en un projecte que tenia com a objectiu estudiar la dinàmica que es produïa en l'alta atmosfera. Per a això, es va centrar en aquelles substàncies emeses a l'atmosfera amb gran freqüència que tenien una llarga vida abans de la seva destrucció. Així, seguint les petjades d'aquestes substàncies, va descobrir com van arribar a l'Antàrtida des dels llocs on es formaven.
Va dir marcadors a aquelles substàncies que anava a utilitzar per a conèixer el comportament de l'atmosfera. Després d'analitzar diverses substàncies, va seleccionar els CFCs per a aquest treball, a causa del seu ús i estabilitat. Mentre seguia la petjada dels CFC, es va adonar que estaven en alta concentració a l'Antàrtida.
Es considerava que els CFCs eren molt estables i que no afectaven a res, per això s'utilitzaven tantes indústries totalment diferents i per a molts propòsits. Però Molina i Rowland van demostrar en 1972 que en els CFCs la irradiació ultraviolada alliberava clor que destruïa ozó.
Quan es va conèixer tot això, els grups ecologistes van iniciar campanyes contra els CFCs per a conscienciar a la gent. D'aquesta forma, es va ampliar la postura contra els CFCs. Els polítics, davant la gravetat de la situació, van donar suport a la prohibició dels CFCs en diverses conferències, sempre amb més lentitud del desitjat pels ecologistes i més ràpid del desitjat per la indústria química.
Es va parlar per primera vegada en la Conferència sobre el Medi humà sobre la capa d'ozó celebrada a Estocolm (1972). En 1977 els experts es van reunir a Washington per a dur a terme el Pla Mundial de la Capa d'Ozó. Quatre anys després, les Nacions Unides van proposar un tractat sobre el problema de la capa d'ozó. El primer acord internacional es va signar a Viena en 1985, on es va exposar la intenció d'investigar les conseqüències de la falta de capa d'ozó.
Però el conveni més conegut és el signat en 1987 a Mont-real. Va ser signat per 165 països, que van aglutinar el 90% de la producció mundial, i el seu objectiu era acabar amb les substàncies destructores de l'ozó. Per a això van establir dues dates: 1996 per als pobles desenvolupats i 2010 per a altres pobles. Amb l'objectiu de reforçar aquest acord es va aconseguir un acord de reunir-se almenys cada quatre anys. Les més importants han estat Viena (1995) i Mont-real (1997). En l'actualitat 180 països han signat el conveni de Mont-real.
Bibliografia
- Ciències de la naturalesa
Vol. 12, Planeta (1997).
Com funciona la naturalesa
Debat (1992).
Uriarte, A.
Ozó: la catàstrofe que no arriba
Tercera Premsa (1995).
Cacho, J. i Sainz d'Aja, J.
Antàrtida: el forat d'ozó.
Tabapress (1989).