Baterías de litio: grandes expectativas e dificultades
Elhuyar Fundazioa
Todas as baterías fabricadas por Alessandro Volta nos próximos 50 anos tras a invención da súa pila eran paira un só uso. Cando se descargaban tirábanse porque non se podían recargar.
Con todo, o físico francés Gaston Plantei inventou en 1859 una batería que se podía recargar unha e outra vez introducindo placas de chumbo en ácido sulfúrico, sistema que se segue utilizando basicamente en automóbiles e camións.
Nestas baterías clásicas hai dúas electrodos: uno o ánodo (polo positivo) e o outro o cátodo (polo negativo), ambos os inmersos nunha solución denominada electrolito. O ánodo é un metal ao que salguen os electróns (cargas negativas). Estes electróns son os utilizados no circuíto exterior (por exemplo, iluminando o farol do automóbil). As cargas positivas restantes (iones metálicos) ao longo do electrolito chegan ao cátodo dentro da batería.

Entre estes dous polos da batería cargada cableado exterior, lámpadas, resistencias, motores eléctricos, etc. o aproveitamento da enerxía acumulada obtense pola súa posta en marcha. Con todo, cando se gasta esa enerxía acumulada, a batería debe ser recargada e paira iso débese facer circular ao ánodo ao revés. En caso contrario, en lugar de extraer enerxía, hai que darlle a tensión ao revés.
Co obxectivo de conseguir sistemas de transporte rápido e masivo de enerxía nun reducido espazo, os electroquímicos están a abrir novas vías de captación de grandes cantidades de iones e electróns. Queren multiplicar a superficie de contacto dos actuais cátodos clásicos aproveitando a “estrutura intercalada”. A estrutura intercalada é a dalgúns sólidos que se adoitan clasificar en finas follas. Na natureza, as micas son o exemplo máis coñecido. Presentan láminas homoxéneas estables e finas segundo un plano, pero ao unirse o plano é débil; é como o pastel de milhojas.
A idea é crear una nova estrutura intercalando láminas delgadas con outras de material. Se ademais desta operación mecánica libéranse electróns na reacción electroquímica, o cátodo terá una gran superficie de contacto e acumularase gran cantidade de enerxía. Ademais o proceso debe ser reversible (hai que recargalo una vez descargado) e os ciclos deben repetirse moitas veces.
O desenvolvemento deste tipo de sistemas iniciouse principalmente nos laboratorios de Bell en Estados Unidos en 1974-75, e desde entón son numerosos os grupos de investigadores que están a traballar neste campo. Como noutros moitos temas, as aplicacións militares han dado un gran impulso ao desenvolvemento de baterías de estrutura intercalada e nas baterías que actualmente conteñen láminas de litio pódese dicir que no mesmo peso acumúlase entre tres e cinco veces máis enerxía que nas clásicas.
Nestas baterías é moi interesante que o ánodo sexa de litio, xa que os átomos de litio son moi pequenos. Os iones Li + que perderon electróns na reacción química co electrolito, poden circular entre láminas de cátodos moi estreitas a intervalos curtos. A miniaturización da batería é moi sinxela.
Ademais dos ánodos de litio, o investigador rodou as estruturas laminares do cátodo. Aínda que a estrutura das láminas apiladas é moi cómoda de imaxinar, os investigadores estudaron outras estruturas. Estas estruturas poden ter a súa organización nunha dimensión (fibras), en dúas dimensións (láminas) ou en tres dimensións (estrutura cristalina).
As fibras presentan a barreira dos túneles, que consiste en que un obstáculo interior rompe todo o tráfico. Non hai costelas paira solucionar o problema. Hai que ter en conta que, sobre todo, preténdese que dentro do cátodo prodúzase un desprazamento importante de moitos iones de litio, o que en definitiva significa que no circuíto de utilización exterior teremos máis electróns ou máis corrente. Neste sentido, as estruturas bidimensionales ou tridimensionales son máis interesantes, aínda que á súa vez sexan máis complexas.
En Estados Unidos e Europa realizáronse numerosas sesións con disulfuro de titanio (IV) (TiS 2). Se se mira aos átomos de titanio e xofre mediante microscopios electrónicos, ven estruturas tridimensionales básicas que se repiten; no caso do TiS 2, octaedros. Con todo, estes octaedros únense regularmente formando láminas. Cada lámina de átomo de titanio atópase entre as outras dúas de átomo de xofre, coma se estivese en sándwich. O espazo débil entre as láminas, denominado tecnicamente “oco de Van der Wals”, atópase entre dúas capas de átomos de xofre.
Nesta estrutura, a pesar dalgúns erros puntuais na práctica, sorprende a mobilidade dos iones Li +, que é similar á dos líquidos. Doutra banda, é sorprendente que, teoricamente, cando o ion Li + conquistou as súas frondosas, o ánodo comeuse por completo.
Aínda que a teoría parece atractiva e esperanzadora, as dificultades paira explotar industrialmente estas baterías de litio non son poucas. Desde hai uns anos está a fabricarse industrialmente pilas de litio. Nos reloxos de boneca compiten as pilas de mercurio, e poida que o que ti levas agora tamén o sexa. Ánodo de litio e cátodo de óxido de manganeso (MnO2). Pero como é evidente, estas pilas non se recargan e o proceso non é reversible.

Para que sexa reversible existen dificultades no aspecto do cátodo. E é que poucas veces a carga é insuficiente: a batería debe poder cargarse e descargarse centos de veces. No ánodo tamén hai dificultades na reversibilidad. Tras varios ciclos aparecen as dentritas entre as láminas e provocan curtocircuítos nocivos.
En 1979 o fabricante norteamericano Exxon lanzou una nova batería fabricando un cátodo con disulfuro de titanio (IV), pero os resultados foron lamentables, xa que só permitía cargar cinco veces.
En 1984 a firma canadense Moli Energy extrae una batería de disulfuro de molibdeno (IV). É certo que se podía cargar 500 veces, pero este tipo de baterías é demasiado sensible á temperatura e non é energéticamente interesante en comparación coas baterías de níquel/cadmio.
A fabricación de compostos de sulfuro paira cátodo é cara e perigosa. A obtención de 100 gramos en laboratorio é sinxela, pero cun quilo de peso o risco de explosión é alto. Por tanto, que medidas deberían tomarse paira o seu uso industrial!
Outra das dificultades é a forza electromotriz ou tensión que se debe alcanzar entre os polos. Cos ánodos de litio e os cátodos de sulfuro conséguese entre 1,3 e 2,5 voltios (2,1 V co cátodo de TiS 2), o que resulta insuficiente cando se queren formar baterías de 12 ou 24 voltios como nos automóbiles.
Na actualidade parece que os cátodos de óxido metálico teñen maior éxito. Por exemplo, o cátodo de óxido de manganeso (IV) (MnO 2) é barato e obtense una forza electromotriz duns 3 V. Sony e Sanyo traballan neste camiño. En Francia, pola súa banda, o cátodo elaborouse con óxido de vanadio (V 2 Ou 5) (ánodo con litio, claro), obtendo una forza electromotriz de 3,2 voltios. O proceso é reversible si non se descarga demasiado a batería. A diferenza das baterías de chumbo, estas de litio non admiten a descarga até 0 voltios. Recoméndase que as baterías de vanadio mencionadas estean a cargarse e descargando entre 2,8 e 3,8 V.
Aínda que a forza electromotriz é adecuada cos cátodos de óxido metálico, a intensidade da corrente debe competir coas baterías clásicas. A enerxía almacenada e fornecida por quilogramo (W.h/kg ou W.h/dm 3) é o dato máis interesante. Os de níquel/cadmio son doutro sistema, pero circulan ao redor de 100 W.h/dm 3 e espérase que cos de níquel/hidruro esta cifra elévese até 150. Nos de litio/vanadio alcanzan os 175 W.h/dm 3. A verdade é que non está mal energéticamente.
Con todo, por unha banda só se pode cargar 100 veces e por outro o electrolito utilizado ten riscos. O electrolito é una sal de litio sólido (LiAsF 6 ). A fórmula mostra que o electrolito involucra ao arsénico e todos sabemos que é moi tóxico.
Aínda que até agora falamos sobre o ánodo e o cátodo, o electrolito ou fase anodo-electrolito é o terceiro campo no que hai que superar as dificultades. Os electroquímicos tamén teñen a palabra.
Con todo, polo momento parece que o coche eléctrico non será accionado por baterías de litio. Ademais da enerxía necesaria paira iso, o litio é un material caro (8.000 pesetas o quilo) e no automóbil cárgase e descarga miles de veces a batería.
De face ao futuro, prevese que as baterías de litio terán aplicacións no espazo e no ámbito militar, onde o prezo non se contempla tanto. Polo demais pódese dicir que se utilizarán en teléfonos, camisetas (videocámara co magnetoscopio integrado), computadores, etc. As industrias xaponesas están a traballar polo menos.
BATERÍA CLÁSICA DO AUTOMÓBIL
Ten dous electrodos mergullados en ácido sulfúrico ou electrolito. O ánodo ou electrodo positivo é de chumbo e tamén de cátodo ou negativo, pero ten una capa de óxido de chumbo (IV).
Cando se envía corrente eléctrica ao circuíto exterior realízase o seguinte proceso. O chumbo do ánodo reacciona ionizando con ácido sulfúrico. O átomo de chumbo libera dous electróns (2e - ) e convértese en Pb ++. O ácido sulfúrico tamén se disocia con dous iones H+ positivos e un ion SO 4 negativo. O resultado da reacción é a formación de SO 4 — e SO 4 Pb mediante a combinación de Pb ++. Os electróns liberados corren o circuíto exterior e tras realizar o seu traballo (acendido da lámpada, por exemplo) chegan ao outro electrodo.
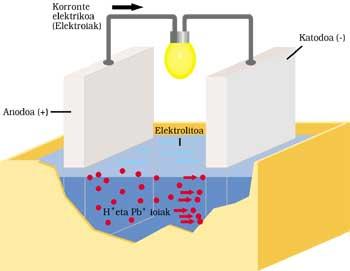
Os dous electróns procedentes do cátodo de óxido de chumbo (IV), ácido sulfúrico, dous iones H + da reacción anterior e ánodo, fornecen sulfato de chumbo e dúas moléculas de auga.
Tras o tempo de funcionamento, parte do electrolito convértese en sal e auga e gástase a capa de óxido de chumbo (IV). A corrente fornecida pola batería é cada vez máis débil, polo que hai que cargala. Paira iso é necesario non extraer enerxía á batería e entregala. SO 4 Pb descomponse mediante a aplicación no primeiro electrodo de Pb e SO 4 H 2. No outro electrodo descomponse SO 4 Pb e extráese Pb 2 e SO 4 H 2.
BATERÍA DE LITIO
Ten dous electrodos mergullados en electrolitos. Os elementos do ánodo e cátodo colocáronse paralelamente entre si por capas e recolléronse todas. O ánodo é un litio puro, o electrolito é sal sólido de litio (LiAsF 6) e o cátodo láminas paralelas de óxido de vanadio (V 2 Ou 5).
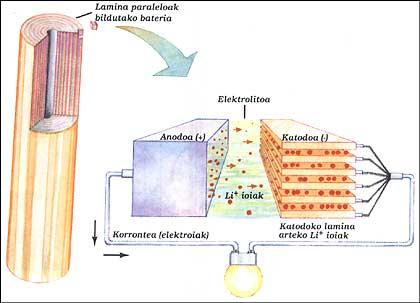
Cando a batería fornece o circuíto exterior, os electróns do ánodo corren o circuíto, mentres que os iones positivos deixan o ánodo no seu interior, atravesan o electrolito e diríxense até as laminas da estrutura do cátodo. Cando hai que cargar a batería, os iones e os electróns funcionan ao revés, paira iso hai que darlle enerxía como na batería clásica.
Este sistema permite obter, á mesma potencia, tamaños entre 3 e 5 veces inferiores ás baterías de níquel/cadmio. Esta vantaxe débese a que o litio é un átomo moi pequeno. Isto permite que os iones de litio circulen entre láminas moi próximas.





