Baterías de litio: grandes expectativas y dificultades
Elhuyar Fundazioa
Todas las baterías fabricadas por Alessandro Volta en los próximos 50 años tras la invención de su pila eran para un solo uso. Cuando se descargaban se tiraban porque no se podían recargar.
Sin embargo, el físico francés Gaston Planté inventó en 1859 una batería que se podía recargar una y otra vez introduciendo placas de plomo en ácido sulfúrico, sistema que se sigue utilizando básicamente en automóviles y camiones.
En estas baterías clásicas hay dos electrodos: uno el ánodo (polo positivo) y el otro el cátodo (polo negativo), ambos inmersos en una solución denominada electrolito. El ánodo es un metal al que salen los electrones (cargas negativas). Estos electrones son los utilizados en el circuito exterior (por ejemplo, iluminando la farola del automóvil). Las cargas positivas restantes (iones metálicos) a lo largo del electrolito llegan al cátodo dentro de la batería.

Entre estos dos polos de la batería cargada cableado exterior, lámparas, resistencias, motores eléctricos, etc. el aprovechamiento de la energía acumulada se obtiene por su puesta en marcha. Sin embargo, cuando se gasta esa energía acumulada, la batería debe ser recargada y para ello se debe hacer circular al ánodo al revés. En caso contrario, en lugar de extraer energía, hay que darle la tensión al revés.
Con el objetivo de conseguir sistemas de transporte rápido y masivo de energía en un reducido espacio, los electroquímicos están abriendo nuevas vías de captación de grandes cantidades de iones y electrones. Quieren multiplicar la superficie de contacto de los actuales cátodos clásicos aprovechando la “estructura intercalada”. La estructura intercalada es la de algunos sólidos que se suelen clasificar en finas hojas. En la naturaleza, las micas son el ejemplo más conocido. Presentan láminas homogéneas estables y finas según un plano, pero al unirse el plano es débil; es como el pastel de milhojas.
La idea es crear una nueva estructura intercalando láminas delgadas con otras de material. Si además de esta operación mecánica se liberan electrones en la reacción electroquímica, el cátodo tendrá una gran superficie de contacto y se acumulará gran cantidad de energía. Además el proceso debe ser reversible (hay que recargarlo una vez descargado) y los ciclos deben repetirse muchas veces.
El desarrollo de este tipo de sistemas se inició principalmente en los laboratorios de Bell en Estados Unidos en 1974-75, y desde entonces son numerosos los grupos de investigadores que están trabajando en este campo. Como en otros muchos temas, las aplicaciones militares han dado un gran impulso al desarrollo de baterías de estructura intercalada y en las baterías que actualmente contienen láminas de litio se puede decir que en el mismo peso se acumula entre tres y cinco veces más energía que en las clásicas.
En estas baterías es muy interesante que el ánodo sea de litio, ya que los átomos de litio son muy pequeños. Los iones Li + que han perdido electrones en la reacción química con el electrolito, pueden circular entre láminas de cátodos muy estrechas a intervalos cortos. La miniaturización de la batería es muy sencilla.
Además de los ánodos de litio, el investigador ha rodado las estructuras laminares del cátodo. Aunque la estructura de las láminas apiladas es muy cómoda de imaginar, los investigadores han estudiado otras estructuras. Estas estructuras pueden tener su organización en una dimensión (fibras), en dos dimensiones (láminas) o en tres dimensiones (estructura cristalina).
Las fibras presentan la barrera de los túneles, que consiste en que un obstáculo interior rompe todo el tráfico. No hay costillas para solucionar el problema. Hay que tener en cuenta que, sobre todo, se pretende que dentro del cátodo se produzca un desplazamiento importante de muchos iones de litio, lo que en definitiva significa que en el circuito de utilización exterior tendremos más electrones o más corriente. En este sentido, las estructuras bidimensionales o tridimensionales son más interesantes, aunque a su vez sean más complejas.
En Estados Unidos y Europa se han realizado numerosas sesiones con disulfuro de titanio (IV) (TiS 2). Si se mira a los átomos de titanio y azufre mediante microscopios electrónicos, se ven estructuras tridimensionales básicas que se repiten; en el caso del TiS 2, octaedros. Sin embargo, estos octaedros se unen regularmente formando láminas. Cada lámina de átomo de titanio se encuentra entre las otras dos de átomo de azufre, como si estuviera en sándwich. El espacio débil entre las láminas, denominado técnicamente “hueco de Van der Wals”, se encuentra entre dos capas de átomos de azufre.
En esta estructura, a pesar de algunos errores puntuales en la práctica, sorprende la movilidad de los iones Li +, que es similar a la de los líquidos. Por otro lado, es sorprendente que, teóricamente, cuando el ion Li + ha conquistado sus frondosas, el ánodo se haya comido por completo.
Aunque la teoría parece atractiva y esperanzadora, las dificultades para explotar industrialmente estas baterías de litio no son pocas. Desde hace unos años se está fabricando industrialmente pilas de litio. En los relojes de muñeca compiten las pilas de mercurio, y puede que lo que tú llevas ahora también lo sea. Ánodo de litio y cátodo de óxido de manganeso (MnO2). Pero como es evidente, estas pilas no se recargan y el proceso no es reversible.

Para que sea reversible existen dificultades en el aspecto del cátodo. Y es que pocas veces la carga es insuficiente: la batería debe poder cargarse y descargarse cientos de veces. En el ánodo también hay dificultades en la reversibilidad. Tras varios ciclos aparecen las dentritas entre las láminas y provocan cortocircuitos nocivos.
En 1979 el fabricante norteamericano Exxon lanzó una nueva batería fabricando un cátodo con disulfuro de titanio (IV), pero los resultados fueron lamentables, ya que sólo permitía cargar cinco veces.
En 1984 la firma canadiense Moli Energy extrae una batería de disulfuro de molibdeno (IV). Es cierto que se podía cargar 500 veces, pero este tipo de baterías es demasiado sensible a la temperatura y no es energéticamente interesante en comparación con las baterías de níquel/cadmio.
La fabricación de compuestos de sulfuro para cátodo es cara y peligrosa. La obtención de 100 gramos en laboratorio es sencilla, pero con un kilo de peso el riesgo de explosión es alto. Por lo tanto, ¡qué medidas deberían tomarse para su uso industrial!
Otra de las dificultades es la fuerza electromotriz o tensión que se debe alcanzar entre los polos. Con los ánodos de litio y los cátodos de sulfuro se consigue entre 1,3 y 2,5 voltios (2,1 V con el cátodo de TiS 2), lo que resulta insuficiente cuando se quieren formar baterías de 12 o 24 voltios como en los automóviles.
En la actualidad parece que los cátodos de óxido metálico tienen mayor éxito. Por ejemplo, el cátodo de óxido de manganeso (IV) (MnO 2) es barato y se obtiene una fuerza electromotriz de unos 3 V. Sony y Sanyo trabajan en este camino. En Francia, por su parte, el cátodo se ha elaborado con óxido de vanadio (V 2 O 5) (ánodo con litio, claro), obteniendo una fuerza electromotriz de 3,2 voltios. El proceso es reversible si no se descarga demasiado la batería. A diferencia de las baterías de plomo, estas de litio no admiten la descarga hasta 0 voltios. Se recomienda que las baterías de vanadio mencionadas se estén cargando y descargando entre 2,8 y 3,8 V.
Aunque la fuerza electromotriz es adecuada con los cátodos de óxido metálico, la intensidad de la corriente debe competir con las baterías clásicas. La energía almacenada y suministrada por kilogramo (W.h/kg o W.h/dm 3) es el dato más interesante. Los de níquel/cadmio son de otro sistema, pero circulan alrededor de 100 W.h/dm 3 y se espera que con los de níquel/hidruro esta cifra se eleve hasta 150. En los de litio/vanadio alcanzan los 175 W.h/dm 3. La verdad es que no está mal energéticamente.
Sin embargo, por un lado sólo se puede cargar 100 veces y por otro el electrolito utilizado tiene riesgos. El electrolito es una sal de litio sólido (LiAsF 6 ). La fórmula muestra que el electrolito involucra al arsénico y todos sabemos que es muy tóxico.
Aunque hasta ahora hemos hablado sobre el ánodo y el cátodo, el electrolito o fase anodo-electrolito es el tercer campo en el que hay que superar las dificultades. Los electroquímicos también tienen la palabra.
Sin embargo, por el momento parece que el coche eléctrico no será accionado por baterías de litio. Además de la energía necesaria para ello, el litio es un material caro (8.000 pesetas el kilo) y en el automóvil se carga y descarga miles de veces la batería.
De cara al futuro, se prevé que las baterías de litio tendrán aplicaciones en el espacio y en el ámbito militar, donde el precio no se contempla tanto. Por lo demás se puede decir que se utilizarán en teléfonos, camisetas (videocámara con el magnetoscopio integrado), ordenadores, etc. Las industrias japonesas están trabajando al menos.
BATERÍA CLÁSICA DEL AUTOMÓVIL
Tiene dos electrodos sumergidos en ácido sulfúrico o electrolito. El ánodo o electrodo positivo es de plomo y también de cátodo o negativo, pero tiene una capa de óxido de plomo (IV).
Cuando se envía corriente eléctrica al circuito exterior se realiza el siguiente proceso. El plomo del ánodo reacciona ionizando con ácido sulfúrico. El átomo de plomo libera dos electrones (2e - ) y se convierte en Pb ++. El ácido sulfúrico también se disocia con dos iones H+ positivos y un ion SO 4 negativo. El resultado de la reacción es la formación de SO 4 — y SO 4 Pb mediante la combinación de Pb ++. Los electrones liberados corren el circuito exterior y tras realizar su trabajo (encendido de la lámpara, por ejemplo) llegan al otro electrodo.
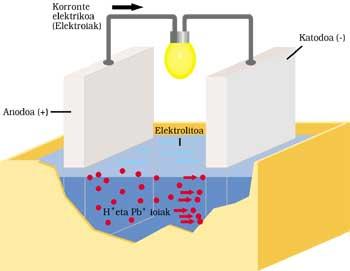
Los dos electrones procedentes del cátodo de óxido de plomo (IV), ácido sulfúrico, dos iones H + de la reacción anterior y ánodo, suministran sulfato de plomo y dos moléculas de agua.
Tras el tiempo de funcionamiento, parte del electrolito se convierte en sal y agua y se gasta la capa de óxido de plomo (IV). La corriente suministrada por la batería es cada vez más débil, por lo que hay que cargarla. Para ello es necesario no extraer energía a la batería y entregarla. SO 4 Pb se descompone mediante la aplicación en el primer electrodo de Pb y SO 4 H 2. En el otro electrodo se descompone SO 4 Pb y se extrae Pb 2 y SO 4 H 2.
BATERÍA DE LITIO
Tiene dos electrodos sumergidos en electrolitos. Los elementos del ánodo y cátodo se han colocado paralelamente entre sí por capas y se han recogido todas. El ánodo es un litio puro, el electrolito es sal sólida de litio (LiAsF 6) y el cátodo láminas paralelas de óxido de vanadio (V 2 O 5).
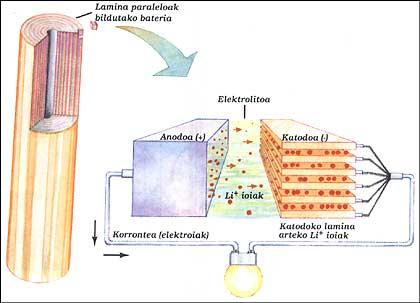
Cuando la batería suministra el circuito exterior, los electrones del ánodo corren el circuito, mientras que los iones positivos dejan el ánodo en su interior, atraviesan el electrolito y se dirigen hasta las laminas de la estructura del cátodo. Cuando hay que cargar la batería, los iones y los electrones funcionan al revés, para ello hay que darle energía como en la batería clásica.
Este sistema permite obtener, a la misma potencia, tamaños entre 3 y 5 veces inferiores a las baterías de níquel/cadmio. Esta ventaja se debe a que el litio es un átomo muy pequeño. Esto permite que los iones de litio circulen entre láminas muy próximas.





