Batteries au lithium : grandes attentes et difficultés
Elhuyar Fundazioa
Toutes les batteries fabriquées par Alessandro Volta dans les 50 prochaines années après l'invention de sa pile étaient à usage unique. Quand ils étaient téléchargés, ils étaient tirés parce qu'ils ne pouvaient pas être rechargés.
Cependant, le physicien français Gaston Planté a inventé en 1859 une batterie qui pouvait être rechargée encore et encore en introduisant des plaques de plomb dans l'acide sulfurique, système qui est encore utilisé principalement dans les automobiles et les camions.
Dans ces batteries classiques il y a deux électrodes: l'une l'anode (pôle positif) et l'autre la cathode (pôle négatif), tous deux immergés dans une solution appelée électrolyte. L'anode est un métal auquel sortent les électrons (charges négatives). Ces électrons sont utilisés sur le circuit extérieur (par exemple en éclairant le lampadaire de l'automobile). Les charges positives restantes (ions métalliques) le long de l'électrolyte atteignent la cathode dans la batterie.

Entre ces deux pôles de la batterie chargée câblage extérieur, lampes, résistances, moteurs électriques, etc. l'utilisation de l'énergie accumulée est obtenue par sa mise en service. Cependant, lorsque l'énergie accumulée est dépensée, la batterie doit être rechargée et pour cela il faut faire circuler l'anode à l'envers. Sinon, au lieu d'extraire de l'énergie, il faut lui donner la tension à l'envers.
Afin d'obtenir des systèmes de transport rapide et massif d'énergie dans un espace réduit, les électrochimiques ouvrent de nouvelles voies de captage de grandes quantités d'ions et d'électrons. Ils veulent multiplier la surface de contact des cathodes classiques actuelles en profitant de la “structure intercalée”. La structure intercalée est celle de certains solides qui sont généralement classés en fines feuilles. Dans la nature, les Mosaïques sont l'exemple le plus connu. Ils présentent des lames homogènes stables et fines selon un plan, mais en rejoignant le plan c'est faible ; c'est comme le gâteau aux feuilles.
L'idée est de créer une nouvelle structure en intercalant des lames minces avec d'autres matériaux. Si en plus de cette opération mécanique des électrons sont libérés dans la réaction électrochimique, la cathode aura une grande surface de contact et accumulera une grande quantité d'énergie. En outre, le processus doit être réversible (il faut le recharger une fois téléchargé) et les cycles doivent être répétés plusieurs fois.
Le développement de ce type de systèmes a commencé principalement dans les laboratoires de Bell aux États-Unis en 1974-75, et depuis lors, de nombreux groupes de chercheurs travaillent dans ce domaine. Comme beaucoup d'autres sujets, les applications militaires ont donné une grande impulsion au développement de batteries de structure intercalée et dans les batteries qui contiennent actuellement des lames de lithium, on peut dire que dans le même poids elle s'accumule entre trois et cinq fois plus d'énergie que dans les classiques.
Dans ces batteries, il est très intéressant que l'anode soit au lithium, car les atomes au lithium sont très petits. Les ions Li + qui ont perdu des électrons dans la réaction chimique avec l'électrolyte, peuvent circuler entre des lames de cathode très étroites à intervalles courts. La miniaturisation de la batterie est très simple.
En plus des anodes au lithium, le chercheur a roulé les structures lamellaires de la cathode. Bien que la structure des lames empilées est très confortable à imaginer, les chercheurs ont étudié d'autres structures. Ces structures peuvent avoir leur organisation dans une dimension (fibres), en deux dimensions (feuilles) ou en trois dimensions (structure cristalline).
Les fibres présentent la barrière des tunnels, qui consiste en ce qu'un obstacle intérieur casse tout le trafic. Il n'y a pas de côtes pour résoudre le problème. Il faut garder à l'esprit que, surtout, il est prévu que dans la cathode se produise un déplacement important de nombreux ions de lithium, ce qui signifie en définitive que dans le circuit d'utilisation extérieure nous aurons plus d'électrons ou plus courant. En ce sens, les structures bidimensionnelles ou tridimensionnelles sont plus intéressantes, même si elles sont plus complexes.
De nombreuses séances de disulfure de titane (IV) ont été organisées aux États-Unis et en Europe (TiS 2). Si on regarde les atomes de titane et de soufre par des microscopes électroniques, on voit des structures tridimensionnelles de base qui se répètent; dans le cas du TiS 2, octaèdres. Cependant, ces octaèdres se lient régulièrement pour former des lames. Chaque feuille d'atome de titane se trouve entre les deux autres d'atome de soufre, comme si elle était en sandwich. L’espace faible entre les lames, appelé techniquement «creux de Van der Wals», se trouve entre deux couches d’atomes de soufre.
Dans cette structure, malgré quelques erreurs ponctuelles dans la pratique, surprend la mobilité des ions Li +, qui est similaire à celle des liquides. D'autre part, il est surprenant que, théoriquement, lorsque l'ion Li + a conquis ses feuillus, l'anode ait été complètement mangé.
Bien que la théorie semble attrayante et encourageante, les difficultés à exploiter industriellement ces batteries au lithium ne sont pas rares. Depuis quelques années, des piles au lithium sont fabriquées industriellement. Dans les montres de poupée rivalisent les piles de mercure, et peut-être ce que vous portez maintenant est aussi. Anode au lithium et cathode d'oxyde de manganèse (MnO2). Mais comme il est évident, ces piles ne sont pas rechargées et le processus n'est pas réversible.

Pour être réversible, il y a des difficultés dans l'aspect de la cathode. Et c'est que rarement la charge est insuffisante : la batterie doit pouvoir être chargée et déchargée des centaines de fois. Dans l'anode, il ya aussi des difficultés dans la réversibilité. Après plusieurs cycles, les dentrites apparaissent entre les lames et provoquent des courts-circuits nocifs.
En 1979, le fabricant américain Exxon a lancé une nouvelle batterie en fabriquant une cathode avec du disulfure de titane (IV), mais les résultats ont été lamentables, car elle ne permettait que de charger cinq fois.
En 1984, la société canadienne Moli Energy extrait une batterie de disulfure de molybdène (IV). Il est vrai qu'il peut être chargé 500 fois, mais ce type de batteries est trop sensible à la température et n'est pas énergétiquement intéressant par rapport aux batteries nickel/cadmium.
La fabrication de composés sulfurés pour la cathode est chère et dangereuse. L'obtention de 100 grammes en laboratoire est simple, mais avec un kilo de poids le risque d'explosion est élevé. Par conséquent, quelles mesures devraient être prises pour un usage industriel!
Une autre difficulté est la force électromotrice ou tension à atteindre entre les pôles. Avec les anodes au lithium et les cathodes de sulfure on obtient entre 1,3 et 2,5 volts (2,1 V avec la cathode de TiS 2), ce qui est insuffisant quand on veut former des batteries de 12 ou 24 volts comme dans les automobiles.
Actuellement, il semble que les cathodes d'oxyde métallique ont plus de succès. Par exemple, la cathode d'oxyde de manganèse (IV) (MnO 2) est bon marché et vous obtenez une force électromotrice d'environ 3 V. Sony et Sanyo travaillent sur cette voie. En France, pour sa part, la cathode a été élaborée avec de l'oxyde de vanadium (V 2 O 5) (anode au lithium, clair), obtenant une force électromotrice de 3,2 volts. Le processus est réversible si la batterie n'est pas trop déchargée. Contrairement aux batteries au plomb, ces batteries au lithium ne prennent pas en charge la décharge jusqu'à 0 volts. Il est recommandé que les batteries vanadium mentionnées soient chargées et déchargées entre 2,8 et 3,8 V.
Bien que la force électromotrice soit adaptée aux cathodes d'oxyde métallique, l'intensité du courant doit rivaliser avec les batteries classiques. L'énergie stockée et fournie par kilogramme (W.h/kg ou W.h/dm 3) est la donnée la plus intéressante. Les nickel/cadmium sont d'un autre système, mais ils circulent environ 100 W.h/dm 3 et on s'attend à ce qu'avec ceux de nickel/hydrure ce chiffre s'élève à 150. Le lithium/vanadium atteint 175 W.h/dm 3. La vérité est qu'il n'est pas mal énergétiquement.
Cependant, d'un côté ne peut être chargé que 100 fois et de l'autre l'électrolyte utilisé a des risques. L'électrolyte est un sel au lithium solide (LiAsF 6 ). La formule montre que l'électrolyte implique l'arsenic et nous savons tous qu'il est très toxique.
Bien que nous ayons parlé jusqu'ici de l'anode et de la cathode, l'électrolyte ou la phase anodo-électrolyte est le troisième domaine dans lequel il faut surmonter les difficultés. Les électrochimiques ont aussi le mot.
Cependant, pour le moment, il semble que la voiture électrique ne sera pas alimenté par des batteries au lithium. En plus de l'énergie nécessaire pour cela, le lithium est un matériau cher (8000 pesetas le kilo) et dans la voiture, il est chargé et déchargé des milliers de fois la batterie.
Pour l'avenir, il est prévu que les batteries au lithium auront des applications dans l'espace et dans le domaine militaire, où le prix n'est pas tant envisagé. En outre, on peut dire qu'ils seront utilisés dans les téléphones, t-shirts (caméscope avec magnétoscope intégré), ordinateurs, etc. Les industries japonaises travaillent au moins.
BATTERIE CLASSIQUE AUTOMOBILE
Il a deux électrodes immergées dans l'acide sulfurique ou électrolyte. L'anode ou électrode positive est en plomb et aussi en cathode ou négatif, mais a une couche d'oxyde de plomb (IV).
Lorsque le courant électrique est envoyé au circuit extérieur, le processus suivant est effectué. Le plomb de l'anode réagit en ionisant avec de l'acide sulfurique. L'atome de plomb libère deux électrons (2e - ) et devient Pb ++. L'acide sulfurique est également associé à deux ions H+ positifs et à un ion SO 4 négatif. Le résultat de la réaction est la formation de SO 4 — et SO 4 Pb en combinant Pb ++. Les électrons libérés courent le circuit extérieur et après avoir fait leur travail (allumage de la lampe, par exemple) ils arrivent à l'autre électrode.
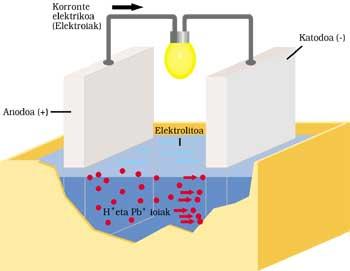
Les deux électrons provenant de la cathode d'oxyde de plomb (IV), acide sulfurique, deux ions H + de la réaction antérieure et anode, fournissent le sulfate de plomb et deux molécules d'eau.
Après le temps de fonctionnement, une partie de l'électrolyte devient sel et eau et la couche d'oxyde de plomb (IV) est dépensée. Le courant fourni par la batterie est de plus en plus faible, il faut donc la charger. Pour cela, il est nécessaire de ne pas extraire l'énergie de la batterie et la livrer. SO 4 Pb est décomposé par l'application sur la première électrode de Pb et SO 4 H 2. Sur l'autre électrode, le SO 4 Pb est décomposé et le SO 4 H 2 est extrait.
BATTERIE LITHIUM
Il a deux électrodes immergées dans des électrolytes. Les éléments de l'anode et la cathode ont été placés parallèlement les uns aux autres par couches et toutes ont été recueillies. L'anode est un lithium pur, l'électrolyte est un sel solide au lithium (LiAsF 6) et la cathode des feuilles parallèles d'oxyde de vanadium (V 2 O 5).
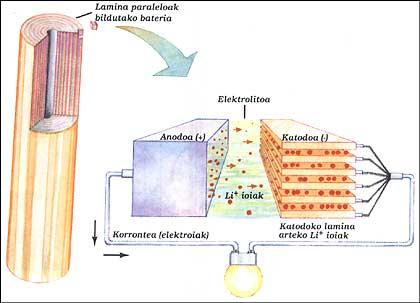
Quand la batterie fournit le circuit extérieur, les électrons de l'anode courent le circuit, tandis que les ions positifs laissent l'anode à l'intérieur, traversent l'électrolyte et se dirigent jusqu'aux lamines de la structure de la cathode. Quand il faut charger la batterie, les ions et les électrons fonctionnent à l'envers, pour cela il faut donner de l'énergie comme dans la batterie classique.
Ce système permet d'obtenir, à la même puissance, des tailles entre 3 et 5 fois inférieures aux batteries nickel/cadmium. Cet avantage est dû au fait que le lithium est un très petit atome. Cela permet aux ions lithium-ion de circuler entre des lames très proches.





