Influencia de la lluvia ácida en los monumentos pétreos

El fenómeno de la lluvia ácida y sus consecuencias son cada vez más importantes en los últimos años. A medida que aumenta el nivel de contaminación, este complejo problema tiene consecuencias incontrolables o incontrolables para nuestro mundo, aunque muchas veces reversibles. No hay solución sencilla, pero es necesario y urgente actuar antes de que sea demasiado tarde o, desgraciadamente, aunque sea tarde.
En muchas ocasiones se ha hablado y escrito sobre el impacto de la lluvia ácida en la naturaleza (bosques, ...). En esta ocasión hablaremos de una curiosa influencia: lo que se hace a los monumentos de piedra, citando algunos ejemplos ilustrativos. Pero primero vamos a ver en qué consiste la lluvia ácida.
¿Qué es la lluvia ácida?
Debido al CO2 presente en la atmósfera, la lluvia es en sí misma ligeramente ácida. Las fuentes de CO2 o dióxido de carbono son naturales y antropogénicas (degradación de la materia orgánica, combustión, ...). Cuando se disuelve en el agua se produce la siguiente reacción:
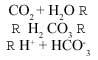
Debido al ácido carbónico producido, el pH de la lluvia natural es aproximadamente de 5,6 (pH = - log [H+]).
Por otro lado, en las zonas industriales y urbanas se generan otros gases ácidos, los más importantes son los óxidos de azufre y nitrógeno, siendo los mayores contaminantes el SO2 (dióxido de azufre) y los NOx (óxidos de nitrógeno (IV) y (II)). La fuente natural de SO2 es la oxidación del SH2 (fuente biogénica) y la fuente antropogénica es, sobre todo, la combustión, siendo la importancia de ambas fuentes similares. En cuanto a los óxidos de NOx, si bien contienen una fuente natural, la más importante es la antropogénica (especialmente la combustión).
El dióxido de azufre (SO2) puede oxirse al óxido de azufre (VI) (SO3), reacción que se produce gracias al oxígeno y ozono presentes en el aire y catalizado por ciertas sustancias metálicas presentes en las partículas contaminantes del aire. Al disolverse el trióxido de azufre (o óxido de azufre) en el agua, puede transformarse en ácido sulfúrico por la reacción:
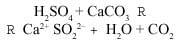
El pH de la lluvia depende de la concentración de SO3 (inversamente proporcional), y se produce principalmente en zonas urbanas de alto tráfico y en zonas industriales, como se ha mencionado anteriormente. El pH del aire cambia cuando llueve. Inicialmente la concentración de SO3 es máxima (pH más bajo). Se ha podido medir el valor de pH=3, lo que supone un incremento del 100% de la concentración de protones respecto a la lluvia normal.
Se pueden escribir reacciones similares para los óxidos de nitrógeno, pero como se explicará más adelante, el mayor impacto sobre los monumentos de piedra es el H2SO4.
Para finalizar esta entrada se puede decir que el problema de la deposición ácida no sólo aparece en lluvia. En la actualidad se distinguen dos partes: por un lado, la deposición seca, es decir, partículas y gases (aerosoles, metales, SO4, SO2, ...) y por otro lado, la deposición húmeda, en la que además de la lluvia se pueden introducir nieve, rocío, niebla y granizo. La influencia de estos últimos no es lenta, ya que en las nubes se ha podido medir pH = 1.
¿Con qué materiales se han construido los monumentos?

Las rocas más comúnmente utilizadas son mármol, caliza, arenisca y granito.
El mármol es una piedra caliza formada por cristalinos de calcita, forma mineral termodinámicamente estable. El mármol es una piedra metamórfica que, a altas temperaturas y presiones, sufre un proceso de recristalización convirtiéndose en una roca sedimentaria (llamada caliza). Químicamente, el mármol y la caliza son iguales, pero morfológicamente se diferencian en la medida y porosidad de los cristales. Los cristalitos de la caliza son más pequeños, por lo que el mármol es más poroso.
La piedra arenisca se utiliza más para la construcción de edificios que en monumentos. Esta piedra es una piedra sedimentaria formada por arenas. La sedimentación de estos granos de arena se puede producir en roca de cuarzo o caliza.
El granito está compuesto principalmente por tres minerales: cuarzo, mica y feldespato. Los granos de granito son generalmente bastante grandes y su porosidad es muy pequeña, por lo que este material se utiliza con frecuencia para proteger las partes bajas de los edificios de la humedad.
Influencia de la lluvia ácida en las piedras
Los monumentos más vulnerables por la lluvia ácida son los de piedra caliza: mármol, caliza y arenisca caliza. La lluvia ácida no afecta a areniscas puras ni granitos.
La reacción entre una piedra caliza y la lluvia ácida se puede expresar de forma simplificada como:
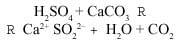
Los mecanismos que controlan la disolución de la calcita dependen de ciertas condiciones: pH, flujo hidrodinámico, etc. El rango más interesante de pH en este tema es 4-6, controlado por transporte y cinética superficial.
Cabe destacar que el daño causado por la disolución química del carbonato cálcico es sobre todo un fenómeno superficial. Por ello, los relieves trabajados sobre las superficies pueden quedar fuertemente deteriorados por la disolución superficial, no afectando a la estructura inferior del mármol.
El problema del deterioro de los monumentos no reside únicamente en la disolución de la calcita. En la ecuación anterior se observa que el carbonato cálcico en las piedras reacciona con la aparición del sulfato cálcico. El compuesto cristalizable en forma de dihidrato de sal es: CaSO4. 2 H2O (yeso). El yeso es bastante soluble en agua. Por tanto, sólo se acumula en superficies que no tienen flujo de agua directo y han reaccionado.
Por ello, los edificios de piedra caliza y los estados de mármol presentan una capa de yeso en zonas protegidas de la lluvia. Debido al aire contaminado (polvo, partículas de carbón, ...) esta capa de yeso se ennegrece. Tras años en esta zona, las piedras calizas presentan un marcado aspecto blanco-negro, blanco en zonas donde la lluvia limpia regularmente el yeso y negro en zonas donde la lluvia no puede limpiarlo, donde la capa oscura de yeso ha pegado una deposición seca.
Como se ha mencionado anteriormente, la lluvia ácida no reacciona sobre superficies arenosas y graníticas. Sin embargo, la deposición seca se pega creando un color negro uniforme.

Las sales solubles de sulfato y nitrato (generadas en la reacción entre la lluvia ácida y las piedras calizas) se disuelven en el mismo agua de lluvia. Esta solución es absorbida por la piedra mediante un mecanismo capilar. Cuando la piedra se seca estas sales se cristalizan en este sistema poroso. La presión generada en este proceso es suficiente para romper mecánicamente la matriz de la piedra. Por tanto, la porosidad de una piedra controla la cantidad de solución que se puede interiorizar y, en definitiva, el tiempo de duración de la misma. El daño causado por esta acción mecánica puede ser más serio que la simple solución química de la piedra.
Algunos ejemplos
El Ayuntamiento de Schenectady (N.Y.), edificio histórico, fue construido en 1930 con el mejor mármol de Vermont (equivalente al mármol de Carrara en Italia). Ha caído casi por la lluvia ácida. La estructura del edificio se ha debilitado debido a la yeso del mármol.
En Pekín (China) hay monumentos de mármol de 500 años que cuentan la historia del imperio. Hasta hace 40 años se podían leer las inscripciones y hoy no se pueden leer. Esto significa que el daño se ha producido sobre todo en los últimos años.
En las columnas de mármol de los emperadores romanos Marcus Aurelius y Traianus se puede observar un fenómeno curioso, como se ha mencionado anteriormente. Los bajorrelieves tratados en las columnas representan las conquistas de estos emperadores. En algunos lugares, estas columnas soportan directamente sobre ellas el flujo de agua de lluvia y el daño descrito varía enormemente en función de los factores que controlan la solución química del mármol. En otros lugares, debido a la protección de los edificios circundantes, la superficie permanece en buen estado, aunque la columna ha sido construida con 1800 años de antelación.
Conclusiones
El deterioro de las piedras calizas se produce principalmente mediante dos mecanismos.
- Solución química de calcita
- El daño mecánico causado por la recristalización de las sales solubles generadas en disolución en los poros de la piedra.
El primer mecanismo es importante cuando se trata de preservar detalles superficiales en esculturas. El segundo mecanismo, sin embargo, puede tener una gran influencia en el deterioro estructural de la piedra. Es difícil distinguir la influencia de cada mecanismo en el deterioro de un estado o monumento.





