Entropía e vida
O obxectivo deste artigo é explicar e filmar o conflito entre a termodinámica e a vida, ou se ambos non son contrapostos nalgúns puntos, sen propor, por suposto, una teoría circular. Paira iso, debemos recoñecer que nos apoiaremos na termodinámica clásica macroscópica e na evolución química da vida. Sabemos tamén que existen outro tipo de termodinámicas (que poden ser máis adecuadas paira describir procesos irreversibles como a vida, e que se mencionan neste artigo) e outras teorías sobre a xénese da vida (como a de Deus ou a da panspernia), pero abordaremos unicamente as xa mencionadas.

O noso obxectivo é utilizar a menor cantidade de fórmulas matemáticas e químicas posible paira facilitar a súa comprensión, aínda que de cando en vez sexa imposible evitar una ou outra.
A termodinámica clásica macroscópica está baseada en tres postulados aos que non se atoparon excepcións. Os dous primeiros pódense definir facilmente, aqueles que teñen importancia paira o noso obxectivo.
O primeiro postulado di que a enerxía non se pode producir nin destruír, aínda que se poida cambiar dun modo a outro. É dicir, a enerxía do Universo é constante. Este postulado ten implicacións directas, por exemplo, cando todos os sistemas móvense de forma espontánea paira conseguir a mínima enerxía, é dicir, os corpos caen de arriba cara abaixo e non se levantan en si mesmos.
A auga sempre vai de arriba abaixo e nunca habemos visto que a auga vai de abaixo cara arriba, ou o avión cae sen motor. Existen outras observacións deste tipo relacionadas con este postulado. Por exemplo, colócase a auga quente xunto co xeo e fúndese, ou se esgotan as pilas do transistor, etc. Dalgunha maneira, téndese a baixar a pendente falando energéticamente.
Aínda que as anteriores afirmacións son adecuadas paira comprender e interiorizar, o primeiro principio da termodinámica non pode responder ás seguintes preguntas: vistes algunha vez dividir una gran masa de auga en dúas, una parte de auga quente e outra de xeo? Ou que o aire dun globo concéntrase nun extremo deixando a outra parte baleira? Ao parecer, o principio de mínima enerxía nos procesos que se producen non é suficiente paira explicar a espontaneidade, e a termodinámica expón un novo postulado.
O segundo principio establece que: En todos os procesos que teñen lugar no universo, a desorde aumenta, é dicir, aumenta a "entropía". Esta palabra é de orixe grega e significa caos ou desorde. Conceptualmente dise que os sistemas ordenados teñen pouca entropía e que os sistemas desordenados teñen moita entropía. A orde/desorde tamén se utiliza como medidor nas ciencias humanas. Na natureza manda a actitude da desorde. As aulas se desordenan de forma natural e temos que facer un traballo de ordenación. Por iso, desta masa de auga non se pode separar propiamente a auga quente do terror, xa que esta distribución implica a creación dunha orde.
Desde o punto de vista termodinámico, os seres vivos poden definirse como rexións localizadas nas que a orde aumenta. É dicir, a aparición e permanencia da vida na Terra, pasando das estructuraciones ás estruturas organizativas que teñen a capacidade de transmitir información (entendida como una definición ampla da vida), supón un proceso de ordenación que podería supor una contradición co segundo principio. Por iso, ás veces aparecen dificultades ou malentendidos.
A partir de agora mergullarémonos neles. Hai que lembrar que a vida e a súa duración non son un proceso illado, senón un sistema aberto, coa súa contorna, co que se intercambia enerxía e masa. Por tanto, o proceso de ordenación do sistema implica simultaneamente o proceso de desordenación da zona e a suma de ambos se dirixe cara á desorde. Parece paradoxal, pero é así.

Creemos que os procesos que tiveron que suceder fai 4.600 millóns de anos desde a constitución da Terra por condensación da nebulosa, até a aparición dos primeiros organismos unicelulares máis simples da vida, 1.000 millóns de anos despois, foron moi complicados e inertes. Probablemente producíronse a través de una serie infinita de sucesos pequenos, e en cada momento en que se producían era imposible retroceder, é dicir, era un proceso irreversible. Como se pode deducir facilmente, deberiamos utilizar a termodinámica de procesos irreversibles, pero ese non é o noso obxectivo.
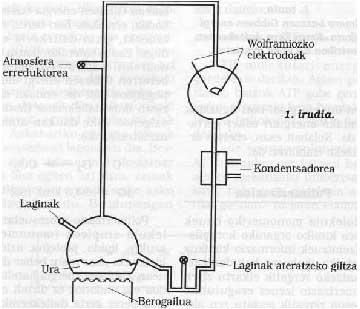
Seguindo a liña, podemos considerar que nesta época a Terra estaba rodeada de atmosferas reflectoras, sen describir detalladamente a súa composición química. Debemos dicir que o osíxeno molecular (02) non estaba libre, polo que as oxidaciones non podían producirse. Proponse que esta atmosfera podería estar formada por N2, CO, NON, H2O, NH3, formando sempre una atmosfera non oxidante, diferente á actual. Neste tipo de mosfera redactora, comprobouse que grazas á luz ultravioleta emitida polo Sol (hai que lembrar que naquela época probablemente non existía ozono) e a toda a enerxía achegada pola actividade volcánica e as tormentas, estes gases inertes reaccionaron. Por exemplo, en 1953, S. Miller demostrou que nesta atmosfera obtíñanse gran cantidade de compostos químicos carros nicos, e o que é sorprendente, son compostos químicos baseados na vida! Ver figura 1.
Recoñecer que o paso do inorgánico ao orgánico pode ser moi sinxelo e saber que é algo eterno (algo así como a afirmación de que a Terra é redonda), sabémolo por un experimento realizado por Wöhler en 1832 (demostrou que un composto inorgánico, cianato amónico, podía obter un composto orgánico quentado, urea). Sempre se considerou que o marco orgánico estaba relacionado cunha forza motriz descoñecida, denominada "forza vital". Hoxe sabemos que o paso dun campo a outro é absolutamente químico.
Nas sesións de Miller demostrouse que moitos dos compostos orgánicos caídos da atmosfera estaban embalados na auga (Ver figura 1 e descrición do ensaio). O paso destas materias primas inorgánicas a estes compostos orgánicos implica o paso dunha desorde a unha orde, todo iso debido á enerxía solar. Dalgunha maneira utilízase paira ordenar a enerxía.
Polimerización
Explicar por que estas moléculas monómeras uníronse paira converterse en estruturas químicas orgánicas complexas (que teñen a capacidade de almacenar información química), é moito máis difícil explicar por que se produciu o proceso coñecido como polimerización, e imos realizar algunhas consideracións paira aclaralas.
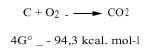
Os químicos estudamos dous aspectos da termodinámica, é dicir, o postulado da mínima enerxía e a entropía, paira saber se una reacción química pode producirse de forma natural ou non. Paira conxugar estas dúas posturas utilizamos o cambio enerxético de Gibbs: si a unha temperatura determinada a enerxía de Gibbs vai diminuíndo, dicimos que esta reacción pode producirse espontaneamente. Por exemplo, o carbón quéimase xunto co osíxeno, xa que a variación enerxética das súas Gibbs é negativa, tal e como se pode observar na seguinte reacción (por iso a atmosfera oxidante na que o osíxeno está libre é oxidante):
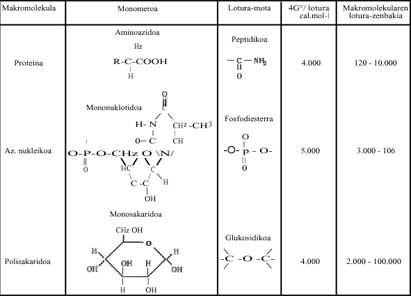
Nos procesos de polimerización, cando as moléculas simples (monómeros) deben formar azucres, lípidos, proteínas, ácidos nucleicos, etc., a enerxía de Gibbs vai aumentando, polo que non parece que a reacción poida producirse de forma espontánea (Ver modificación enerxética modificada de Gibbs dalgúns dos polímeros escritos na táboa 1 seguinte). Que pasa? Nos seres vivos, nos nosos corpos, respondemos dicindo que estas reaccións sempre están a ocorrer (pola contra estariamos mortos), pero como e por que se producen?
Hai que dicir que as reaccións intracelulares (consideradas paira elementos vivos simples) non se producen en sistemas illados, senón que a propia célula é un sistema aberto, é dicir, existe un intercambio. As reaccións de polimerización débense a que se están producindo simultaneamente outras reaccións moi exergónicas (das que liberan enerxía de Gibbs).
Estas reaccións exergónicas son aquelas que liberan moita enerxía. Falando metaforicamente, son solares químicos locais. Esta enerxía liberada axuda á polimerización. Sen Bes, estamos a falar de Adenosin Trifosfato (ATP), que ao hidrolizar libera moita enerxía libre. Todas as polimerizaciones que se producen nos seres vivos débense ao ATP (Ver Táboa 1). Pódese escribir brevemente:

A molécula de ATP chámase almacenamento de enerxía. É posible que algunhas polimerizaciones prodúzanse sen ATP, probablemente porque interveñen moléculas equivalentes como a mesma.
Se as polimerizaciones actuais prodúcense grazas ao ATP, sendo un mecanismo totalmente universal, como se podían producir na época mencionada? Nesta evolución química da vida xa se formou o ATP? Estas preguntas, por suposto, non teñen nada que ver coa termodinámica e nós, os químicos, non podemos responderlles correctamente. Con todo, nesta Táboa 2 escribíronse varias moléculas que puideron utilizarse como "sol local" e que poden sintetizarse facilmente nos ensaios realizados por Miller. Casualidade? O que hai que deixar claro é que os procesos de polimerización, é dicir, o paso da desorde á orde, puideron producirse coa axuda de reaccións que liberan enerxía libre (ou enerxía de Gibbs).
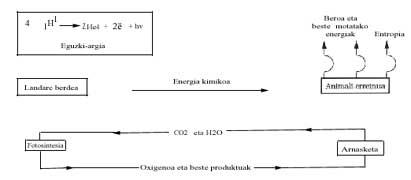
Desde o punto de vista enerxético, analízase a continuación o balance enerxético da vida actual e as súas posibles consecuencias. Sabemos que o Sol emite moita enerxía e realiza unha longa viaxe e realiza "filtros" na atmosfera terrestre (capa de ozono, etc.) Una vez superada, chega até a superficie terrestre. A enerxía visible utilízase unicamente no proceso denominado fotosíntesis, onde se sintetiza a glicosa (C6H1206) das materias primas CO2 e H2O. A pesar de que o cambio enerxético de Gibbs é endergónico nesta reacción, a enerxía fornecida polo Sol permite a súa realización, segundo a seguinte ecuación:

As plantas verdes utilizan pola noite (á noitiña) esta glicosa e quéimana con osíxeno paira poder levar a cabo outros procesos de polimerización coa enerxía liberada. O reino animal aproveita (come) o traballo químico da fotosíntesis das plantas verdes e obtén enerxía grazas á combustión de glicosa (ou de graxa ou outras sustancias).
Se esta queima producísese como a queima de madeira ou carbón no lume, de inmediato poderíase deducir que só se lograría queimar o "corpo", é dicir, que a enerxía liberada en dita queima rompería enlácelos químicos dos compostos bioquímicos que se degradarían mediante a administración de C02 e H2O.
A evolución da vida, Natureza, máis rápida do aquí exposto, sufriu una evolución natural a través dun mecanismo de liberación progresiva desta enerxía, que ademais a acumula como enerxía química. De novo vénnos á cabeza aquela molécula de ATP.
Os seres vivos consumimos enerxía paira levar a cabo diferentes tipos de traballo, é dicir, procesos que non se producirían por si mesmos segundo o definido pola termodinámica clásica macroscópica. Estes procesos podemos expresalos como:
- Os oligoelementos e materias primas, é dicir, a “comida”, deben ser transportados, transportados e transportados a todas as células que compoñen a entidade viva. Paira iso hai que traballar e esta concentración e/ou transporte non é nada fácil. Preguntástesvos algunha vez que cansazo ten que ter subir a auga e os sales das raíces até a cima dunha árbore?, ou como é o bombeo que ten que facer o corazón paira enviar sangue até o dedo e a enerxía que consome? Hai que transportar e concentrar moitas cousas nos corpos.
- Ademais, necesítase moita enerxía paira polimerizar, por exemplo, paira sintetizar moléculas de ADN que teñen a capacidade de transmitir á súa descendentes información xenética dos seus antepasados. É dicir, paira asegurar a supervivencia da vida necesítase enerxía. (En definitiva, seguimos vivos porque nos alimentamos a curto prazo, pero só se nos reproducimos como especie a longo prazo).
- Por último, realizamos algúns traballos físicos como a contracción dos músculos… e calquera traballo que desprenda calor. É dicir, a calor que desprende o ser vivo, o que absorbe o
medio e por tanto aumenta a entropía local. Por iso, neste proceso natural, vivo, vai aumentando a entropía ou a desorde do universo.
De acordo co anterior, pódese afirmar que: Que a aparición e desenvolvemento da vida no planeta Terra non son procesos contrarios ao segundo principio da termodinámica. Nós quixemos explicar un deles que cumpre o principio. Se dicimos que a verdade é redonda, deberiamos recoñecer que non fixemos máis que una aproximación, e nas liñas que seguen trataremos de pola de manifesto.
Por unha banda, a termodinámica clásica macroscópica utilizada predí os cambios que poden producirse nos sistemas macroscópicos equilibrados e así se aplicou á célula. Con todo, reflexionando darémonos conta da debilidade desta aproximación. Sabemos que a célula é algo moi microscópico. Por tanto, as concentracións macroscópicas e as concentracións nelas poden ser moi diferentes. É máis, a célula non é un sistema illado, senón aberto, como se mencionou anteriormente, polo que é un sistema non equilibrado e non equilibrado. Con todo, a concentración de gran cantidade de materias primas mantense practicamente constante ao longo do tempo. Por iso a esta situación chámaselle estado estacionario (falso equilibrado).
A aparición da vida foi, basicamente, un proceso natural e por tanto irreversible. Neste caso sería moito máis apropiado utilizar una termodinámica irreversible que a termodinámica clásica, cuxa descrición queda fóra deste artigo.
Na Universidade de Chicago S. Miller e H. Esquema do utillaje utilizado por Urey. As súas condicións experimentais simulábanse na Terra primitiva. Desde a chave da esquerda introduciuse una atmosfera de gases redactores, que se excitaba cunha forte faísca eléctrica (naquela época pode considerarse enerxía emitida polo Sol). A auga do matraz inferior quentábase (naquela época considerábase que a Terra estaba moi quente) e arrefriábase mediante un condensador caendo en forma de pinga de choiva. Os compostos disoltos nestas pingas de auga acumulábanse na parte inferior e coa chave da mesma extraer periodicamente mostras.
O 15% de todo o carbono metano introducido nestas sesións converteuse nun composto bioquímico, como a glicina, a alanina, o ácido glutámico, a urea, etc. (polo menos una vintena de compostos diferentes) e outra gran porcentaxe en forma de area alquitranada. É sorprendente que a maioría dos aminoácidos que forman as proteínas póidanse conseguir nestas sesións e máis aínda na maioría dos compostos que sustentan a vida. É pura casualidade ou a vida puido aparecer coa evolución destes compostos?