Entropia i vida
L'objectiu d'aquest article és explicar i filmar el conflicte entre la termodinàmica i la vida, o si tots dos no són contraposats en alguns punts, sense proposar, per descomptat, una teoria circular. Per a això, hem de reconèixer que ens recolzarem en la termodinàmica clàssica macroscòpica i en l'evolució química de la vida. Sabem també que existeixen un altre tipus de termodinàmiques (que poden ser més adequades per a descriure processos irreversibles com la vida, i que s'esmenten en aquest article) i altres teories sobre la gènesi de la vida (com la de Déu o la de la panspernia), però abordarem únicament les ja esmentades.

El nostre objectiu és utilitzar la menor quantitat de fórmules matemàtiques i químiques possible per a facilitar la seva comprensió, encara que de tant en tant hagi estat impossible evitar l'una o l'altra.
La termodinàmica clàssica macroscòpica està basada en tres postulats als quals no s'han trobat excepcions. Els dos primers es poden definir fàcilment, aquells que tenen importància per al nostre objectiu.
El primer postulat diu que l'energia no es pot produir ni destruir, encara que es pugui canviar d'una manera a un altre. És a dir, l'energia de l'Univers és constant. Aquest postulat té implicacions directes, per exemple, quan tots els sistemes es mouen de manera espontània per a aconseguir la mínima energia, és a dir, els cossos cauen de dalt cap avall i no s'aixequen en si mateixos.
L'aigua sempre va de dalt a baix i mai hem vist que l'aigua va de baix cap amunt, o l'avió cau sense motor. Existeixen altres observacions d'aquest tipus relacionades amb aquest postulat. Per exemple, es col·loca l'aigua calenta juntament amb el gel i es fundi, o s'esgoten les piles del transistor, etc. D'alguna manera, es tendeix a baixar el pendent parlant energèticament.
Encara que les anteriors afirmacions són adequades per a comprendre i interioritzar, el primer principi de la termodinàmica no pot respondre a les següents preguntes: heu vist alguna vegada dividir una gran massa d'aigua en dues, una part d'aigua calenta i una altra de gel? O que l'aire d'un globus es concentra en un extrem deixant l'altra part buida? Pel que sembla, el principi de mínima energia en els processos que es produeixen no és suficient per a explicar l'espontaneïtat, i la termodinàmica planteja un nou postulat.
El segon principi estableix que: En tots els processos que tenen lloc en l'univers, el desordre augmenta, és a dir, augmenta l'entropia "". Aquesta paraula és d'origen grec i significa caos o desordre. Conceptualment es diu que els sistemes ordenats tenen poca entropia i que els sistemes desordenats tenen molta entropia. L'ordre/desordre també s'utilitza com a mesurador en les ciències humanes. En la naturalesa mana l'actitud del desordre. Les aules es desordenen de manera natural i hem de fer un treball d'ordenació. Per això, d'aquesta massa d'aigua no es pot separar pròpiament l'aigua calenta del terror, ja que aquesta distribució implica la creació d'un ordre.
Des del punt de vista termodinàmic, els éssers vius poden definir-se com a regions localitzades en les quals l'ordre augmenta. És a dir, l'aparició i permanència de la vida en la Terra, passant de les estructuracions a les estructures organitzatives que tenen la capacitat de transmetre informació (entesa com una definició àmplia de la vida), suposa un procés d'ordenació que podria suposar una contradicció amb el segon principi. Per això, a vegades apareixen dificultats o malentesos.
A partir d'ara ens submergirem en ells. Cal recordar que la vida i la seva durada no són un procés aïllat, sinó un sistema obert, amb el seu entorn, amb el qual s'intercanvia energia i massa. Per tant, el procés d'ordenació del sistema implica simultàniament el procés de desordenación de la zona i la suma de tots dos es dirigeix cap al desordre. Sembla paradoxal, però és així.

Creiem que els processos que van haver de succeir fa 4.600 milions d'anys des de la constitució de la Terra per condensació de la nebulosa, fins a l'aparició dels primers organismes unicel·lulars més simples de la vida, 1.000 milions d'anys després, van ser molt complicats i inerts. Probablement es van produir a través d'una sèrie infinita de successos petits, i a cada moment en què es produïen era impossible retrocedir, és a dir, era un procés irreversible. Com es pot deduir fàcilment, hauríem d'utilitzar la termodinàmica de processos irreversibles, però aquest no és el nostre objectiu.
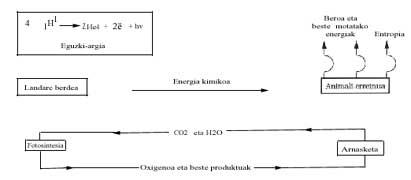
Seguint la línia, podem considerar que en aquesta època la Terra estava envoltada d'atmosferes reflectores, sense descriure detalladament la seva composició química. Hem de dir que l'oxigen molecular (02) no estava lliure, per la qual cosa les oxidacions no podien produir-se. Es proposa que aquesta atmosfera podria estar formada per N2, CO, NO, H?O, NH3, formant sempre una atmosfera no oxidant, diferent a l'actual. En aquesta mena de mosfera redactora, s'ha comprovat que gràcies a la llum ultraviolada emesa pel Sol (cal recordar que en aquella època probablement no existia ozó) i a tota l'energia aportada per l'activitat volcànica i les tempestes, aquests gasos inerts van reaccionar. Per exemple, en 1953, S. Miller va demostrar que en aquesta atmosfera s'obtenien gran quantitat de compostos químics carros nicos, i el que és sorprenent, són compostos químics basats en la vida! Veure figura 1.
Reconèixer que el pas de l'inorgànic a l'orgànic pot ser molt senzill i saber que és una cosa eterna (alguna cosa així com l'afirmació que la Terra és rodona), ho sabem per un experiment realitzat per Wöhler en 1832 (va demostrar que un compost inorgànic, cianato amònic, podia obtenir un compost orgànic escalfat, urea). Sempre s'ha considerat que el marc orgànic estava relacionat amb una força motriu desconeguda, denominada "força vital". Avui sabem que el pas d'un camp a un altre és absolutament químic.
En les sessions de Miller es va demostrar que molts dels compostos orgànics caiguts de l'atmosfera estaven embalats en l'aigua (Veure figura 1 i descripció de l'assaig). El pas d'aquestes matèries primeres inorgàniques a aquests compostos orgànics implica el pas d'un desordre a un ordre, tot això a causa de l'energia solar. D'alguna manera s'utilitza per a ordenar l'energia.
Polimerització
Explicar per què aquestes molècules monómeras es van unir per a convertir-se en estructures químiques orgàniques complexes (que tenen la capacitat d'emmagatzemar informació química), és molt més difícil explicar per què es va produir el procés conegut com a polimerització, i realitzarem algunes consideracions per a aclarir-les.
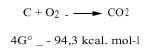
Els químics estudiem dos aspectes de la termodinàmica, és a dir, el postulat de la mínima energia i l'entropia, per a saber si una reacció química pot produir-se de manera natural o no. Per a conjugar aquestes dues postures utilitzem el canvi energètic de Gibbs: si a una temperatura determinada l'energia de Gibbs va disminuint, diem que aquesta reacció pot produir-se espontàniament. Per exemple, el carbó es crema juntament amb l'oxigen, ja que la variació energètica de les seves Gibbs és negativa, tal com es pot observar en la següent reacció (per això l'atmosfera oxidant en la qual l'oxigen està lliure és oxidant):
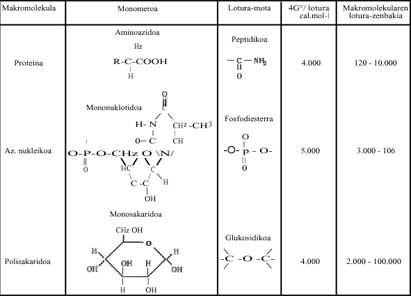
En els processos de polimerització, quan les molècules simples (monòmers) han de formar sucres, lípids, proteïnes, àcids nucleics, etc., l'energia de Gibbs va augmentant, per la qual cosa no sembla que la reacció pugui produir-se de manera espontània (Veure modificació energètica modificada de Gibbs d'alguns dels polímers escrits en la taula 1 següent). Què passa? En els éssers vius, en els nostres cossos, hem respost dient que aquestes reaccions sempre estan ocorrent (en cas contrari estaríem morts), però com i per què es produeixen?
Cal dir que les reaccions intracel·lulars (considerades per a elements vius simples) no es produeixen en sistemes aïllats, sinó que la pròpia cèl·lula és un sistema obert, és a dir, existeix un intercanvi. Les reaccions de polimerització es deuen al fet que s'estan produint simultàniament altres reaccions molt exergónicas (de les quals alliberen energia de Gibbs).
Aquestes reaccions exergónicas són aquelles que alliberen molta energia. Parlant metafòricament, són solars químics locals. Aquesta energia alliberada ajuda a la polimerització. Sense Bes, estem parlant d'Adenosin Trifosfat (ATP), que en hidrolitzar allibera molta energia lliure. Totes les polimeritzacions que es produeixen en els éssers vius es deuen a l'ATP (Veure Taula 1). Es pot escriure breument:

La molècula d'ATP es diu emmagatzematge d'energia. És possible que algunes polimeritzacions es produeixin sense ATP, probablement perquè intervenen molècules equivalents com aquesta.
Si les polimeritzacions actuals es produeixen gràcies a l'ATP, sent un mecanisme totalment universal, com es podien produir en l'època esmentada? En aquesta evolució química de la vida ja s'havia format l'ATP? Aquestes preguntes, per descomptat, no tenen res a veure amb la termodinàmica i nosaltres, els químics, no podem respondre'ls correctament. No obstant això, en aquesta Taula 2 s'han escrit diverses molècules que van poder utilitzar-se com a sol "local" i que poden sintetitzar-se fàcilment en els assajos realitzats per Miller. Casualitat? El que cal deixar clar és que els processos de polimerització, és a dir, el pas del desordre a l'ordre, van poder produir-se amb l'ajuda de reaccions que alliberen energia lliure (o energia de Gibbs).
Des del punt de vista energètic, s'analitza a continuació el balanç energètic de la vida actual i les seves possibles conseqüències. Sabem que el Sol emet molta energia i realitza un llarg viatge i realitza "filtres" en l'atmosfera terrestre (capa d'ozó, etc.) Una vegada superada, arriba fins a la superfície terrestre. L'energia visible s'utilitza únicament en el procés denominat fotosíntesi, on se sintetitza la glucosa (C6H1206) de les matèries primeres CO2 i H?O. A pesar que el canvi energètic de Gibbs és endergónico en aquesta reacció, l'energia subministrada pel Sol permet la seva realització, segons la següent equació:

Les plantes verdes utilitzen a la nit (en fosquejar) aquesta glucosa i la cremen amb oxigen per a poder dur a terme altres processos de polimerització amb l'energia alliberada. El regne animal aprofita (menja) el treball químic de la fotosíntesi de les plantes verdes i obté energia gràcies a la combustió de glucosa (o de greix o altres substàncies).
Si aquesta crema es produís com la crema de fusta o carbó en el foc, immediatament es podria deduir que només s'aconseguiria cremar el "cos", és a dir, que l'energia alliberada en aquesta crema trencaria els enllaços químics dels compostos bioquímics que es degradarien mitjançant l'administració de C02 i H?O.
L'evolució de la vida, Naturalesa, més ràpida de l'aquí exposat, ha sofert una evolució natural a través d'un mecanisme d'alliberament progressiu d'aquesta energia, que a més l'acumula com a energia química. De nou ens ve al capdavant aquella molècula d'ATP.
Els éssers vius consumim energia per a dur a terme diferents tipus de treball, és a dir, processos que no es produirien per si mateixos segons el definit per la termodinàmica clàssica macroscòpica. Aquests processos podem expressar-los com:
- Els oligoelementos i matèries primeres, és a dir, el “menjar”, han de ser transportats, transportats i transportats a totes les cèl·lules que componen l'entitat viva. Per a això cal treballar i aquesta concentració i/o transport no és gens fàcil. Us heu preguntat alguna vegada quin cansament ha de tenir pujar l'aigua i les sals de les arrels fins al cim d'un arbre?, o com és el bombament que ha de fer el cor per a enviar sang fins al dit i l'energia que consumeix? Cal transportar i concentrar moltes coses en els cossos.
- A més, es necessita molta energia per a polimeritzar, per exemple, per a sintetitzar molècules d'ADN que tenen la capacitat de transmetre a les seves descendents informació genètica dels seus avantpassats. És a dir, per a assegurar la supervivència de la vida es necessita energia. (En definitiva, continuem vius perquè ens alimentem a curt termini, però només si ens reproduïm com a espècie a llarg termini).
- Finalment, fem alguns treballs físics com la contracció dels músculs… i qualsevol treball que desprengui calor. És a dir, la calor que desprèn l'ésser viu, el que absorbeix el
mitjà i per tant augmenta l'entropia local. Per això, en aquest procés natural, viu, va augmentant l'entropia o el desordre de l'univers.
D'acord amb l'anterior, es pot afirmar que: Que l'aparició i desenvolupament de la vida en el planeta Terra no són processos contraris al segon principi de la termodinàmica. Nosaltres hem volgut explicar un d'ells que compleix el principi. Si diem que la veritat és rodona, hauríem de reconèixer que no hem fet més que una aproximació, i en les línies que segueixen tractarem de posar-la de manifest.
D'una banda, la termodinàmica clàssica macroscòpica utilitzada prediu els canvis que poden produir-se en els sistemes macroscòpics equilibrats i així s'ha aplicat a la cèl·lula. No obstant això, reflexionant ens adonarem de la feblesa d'aquesta aproximació. Sabem que la cèl·lula és una cosa molt microscòpica. Per tant, les concentracions macroscòpiques i les concentracions en elles poden ser molt diferents. És més, la cèl·lula no és un sistema aïllat, sinó obert, com s'ha esmentat anteriorment, per la qual cosa és un sistema no equilibrat i no equilibrat. No obstant això, la concentració de gran quantitat de matèries primeres es manté pràcticament constant al llarg del temps. Per això a aquesta situació se'n diu estat estacionari (fals equilibrat).
L'aparició de la vida ha estat, bàsicament, un procés natural i per tant irreversible. En aquest cas seria molt més apropiat utilitzar una termodinàmica irreversible que la termodinàmica clàssica, la descripció de la qual queda fora d'aquest article.
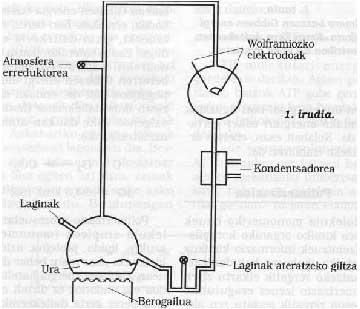
En la Universitat de Chicago S. Miller i H. Esquema de l'utillatge utilitzat per Urey. Les seves condicions experimentals se simulaven en la Terra primitiva. Des de la clau de l'esquerra es va introduir una atmosfera de gasos redactors, que s'excitava amb una forta espurna elèctrica (en aquella època pot considerar-se energia emesa pel Sol). L'aigua del matràs inferior s'escalfava (en aquella època es considerava que la Terra estava molt calenta) i es refredava mitjançant un condensador caient en forma de gota de pluja. Els compostos dissolts en aquestes gotes d'aigua s'acumulaven en la part inferior i amb la clau de la mateixa s'extreien periòdicament mostres.
El 15% de tot el carboni metà introduït en aquestes sessions s'havia convertit en un compost bioquímic, com la glicina, l'alanina, l'àcid glutàmic, la urea, etc. (almenys una vintena de compostos diferents) i un altre gran percentatge en forma de sorra alquitranada. És sorprenent que la majoria dels aminoàcids que formen les proteïnes es puguin aconseguir en aquestes sessions i més encara en la majoria dels compostos que sustenten la vida. És pura casualitat o la vida va poder aparèixer amb l'evolució d'aquests compostos?