Entropía y vida
El objetivo de este artículo es explicar y filmar el conflicto entre la termodinámica y la vida, o si ambos no son contrapuestos en algunos puntos, sin proponer, por supuesto, una teoría circular. Para ello, debemos reconocer que nos apoyaremos en la termodinámica clásica macroscópica y en la evolución química de la vida. Sabemos también que existen otro tipo de termodinámicas (que pueden ser más adecuadas para describir procesos irreversibles como la vida, y que se mencionan en este artículo) y otras teorías sobre la génesis de la vida (como la de Dios o la de la panspernia), pero abordaremos únicamente las ya mencionadas.

Nuestro objetivo es utilizar la menor cantidad de fórmulas matemáticas y químicas posible para facilitar su comprensión, aunque de vez en cuando haya sido imposible evitar una u otra.
La termodinámica clásica macroscópica está basada en tres postulados a los que no se han encontrado excepciones. Los dos primeros se pueden definir fácilmente, aquellos que tienen importancia para nuestro objetivo.
El primer postulado dice que la energía no se puede producir ni destruir, aunque se pueda cambiar de un modo a otro. Es decir, la energía del Universo es constante. Este postulado tiene implicaciones directas, por ejemplo, cuando todos los sistemas se mueven de forma espontánea para conseguir la mínima energía, es decir, los cuerpos caen de arriba hacia abajo y no se levantan en sí mismos.
El agua siempre va de arriba abajo y nunca hemos visto que el agua va de abajo hacia arriba, o el avión se cae sin motor. Existen otras observaciones de este tipo relacionadas con este postulado. Por ejemplo, se coloca el agua caliente junto con el hielo y se funde, o se agotan las pilas del transistor, etc. De alguna manera, se tiende a bajar la pendiente hablando energéticamente.
Aunque las anteriores afirmaciones son adecuadas para comprender e interiorizar, el primer principio de la termodinámica no puede responder a las siguientes preguntas: ¿habéis visto alguna vez dividir una gran masa de agua en dos, una parte de agua caliente y otra de hielo? ¿O que el aire de un globo se concentra en un extremo dejando la otra parte vacía? Al parecer, el principio de mínima energía en los procesos que se producen no es suficiente para explicar la espontaneidad, y la termodinámica plantea un nuevo postulado.
El segundo principio establece que: En todos los procesos que tienen lugar en el universo, el desorden aumenta, es decir, aumenta la "entropía". Esta palabra es de origen griego y significa caos o desorden. Conceptualmente se dice que los sistemas ordenados tienen poca entropía y que los sistemas desordenados tienen mucha entropía. El orden/desorden también se utiliza como medidor en las ciencias humanas. En la naturaleza manda la actitud del desorden. Las aulas se desordenan de forma natural y tenemos que hacer un trabajo de ordenación. Por ello, de esta masa de agua no se puede separar propiamente el agua caliente del terror, ya que esta distribución implica la creación de un orden.
Desde el punto de vista termodinámico, los seres vivos pueden definirse como regiones localizadas en las que el orden aumenta. Es decir, la aparición y permanencia de la vida en la Tierra, pasando de las estructuraciones a las estructuras organizativas que tienen la capacidad de transmitir información (entendida como una definición amplia de la vida), supone un proceso de ordenación que podría suponer una contradicción con el segundo principio. Por ello, a veces aparecen dificultades o malentendidos.
A partir de ahora nos sumergiremos en ellos. Hay que recordar que la vida y su duración no son un proceso aislado, sino un sistema abierto, con su entorno, con el que se intercambia energía y masa. Por lo tanto, el proceso de ordenación del sistema implica simultáneamente el proceso de desordenación de la zona y la suma de ambos se dirige hacia el desorden. Parece paradójico, pero es así.

Creemos que los procesos que tuvieron que suceder hace 4.600 millones de años desde la constitución de la Tierra por condensación de la nebulosa, hasta la aparición de los primeros organismos unicelulares más simples de la vida, 1.000 millones de años después, fueron muy complicados e inertes. Probablemente se produjeron a través de una serie infinita de sucesos pequeños, y en cada momento en que se producían era imposible retroceder, es decir, era un proceso irreversible. Como se puede deducir fácilmente, deberíamos utilizar la termodinámica de procesos irreversibles, pero ese no es nuestro objetivo.
Siguiendo la línea, podemos considerar que en esta época la Tierra estaba rodeada de atmósferas reflectoras, sin describir detalladamente su composición química. Debemos decir que el oxígeno molecular (02) no estaba libre, por lo que las oxidaciones no podían producirse. Se propone que esta atmósfera podría estar formada por N2, CO, NO, H2O, NH3, formando siempre una atmósfera no oxidante, diferente a la actual. En este tipo de mosfera redactora, se ha comprobado que gracias a la luz ultravioleta emitida por el Sol (hay que recordar que en aquella época probablemente no existía ozono) y a toda la energía aportada por la actividad volcánica y las tormentas, estos gases inertes reaccionaron. Por ejemplo, en 1953, S. Miller demostró que en esta atmósfera se obtenían gran cantidad de compuestos químicos carros nicos, y lo que es sorprendente, ¡son compuestos químicos basados en la vida! Ver figura 1.
Reconocer que el paso de lo inorgánico a lo orgánico puede ser muy sencillo y saber que es algo eterno (algo así como la afirmación de que la Tierra es redonda), lo sabemos por un experimento realizado por Wöhler en 1832 (demostró que un compuesto inorgánico, cianato amónico, podía obtener un compuesto orgánico calentado, urea). Siempre se ha considerado que el marco orgánico estaba relacionado con una fuerza motriz desconocida, denominada "fuerza vital". Hoy sabemos que el paso de un campo a otro es absolutamente químico.
En las sesiones de Miller se demostró que muchos de los compuestos orgánicos caídos de la atmósfera estaban embalados en el agua (Ver figura 1 y descripción del ensayo). El paso de estas materias primas inorgánicas a estos compuestos orgánicos implica el paso de un desorden a un orden, todo ello debido a la energía solar. De alguna manera se utiliza para ordenar la energía.
Polimerización
Explicar por qué estas moléculas monómeras se unieron para convertirse en estructuras químicas orgánicas complejas (que tienen la capacidad de almacenar información química), es mucho más difícil explicar por qué se produjo el proceso conocido como polimerización, y vamos a realizar algunas consideraciones para aclararlas.
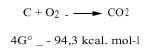
Los químicos estudiamos dos aspectos de la termodinámica, es decir, el postulado de la mínima energía y la entropía, para saber si una reacción química puede producirse de forma natural o no. Para conjugar estas dos posturas utilizamos el cambio energético de Gibbs: si a una temperatura determinada la energía de Gibbs va disminuyendo, decimos que esta reacción puede producirse espontáneamente. Por ejemplo, el carbón se quema junto con el oxígeno, ya que la variación energética de sus Gibbs es negativa, tal y como se puede observar en la siguiente reacción (por ello la atmósfera oxidante en la que el oxígeno está libre es oxidante):
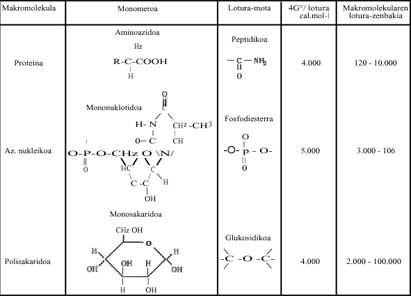
En los procesos de polimerización, cuando las moléculas simples (monómeros) deben formar azúcares, lípidos, proteínas, ácidos nucleicos, etc., la energía de Gibbs va aumentando, por lo que no parece que la reacción pueda producirse de forma espontánea (Ver modificación energética modificada de Gibbs de algunos de los polímeros escritos en la tabla 1 siguiente). ¿Qué pasa? En los seres vivos, en nuestros cuerpos, hemos respondido diciendo que estas reacciones siempre están ocurriendo (de lo contrario estaríamos muertos), pero ¿cómo y por qué se producen?
Hay que decir que las reacciones intracelulares (consideradas para elementos vivos simples) no se producen en sistemas aislados, sino que la propia célula es un sistema abierto, es decir, existe un intercambio. Las reacciones de polimerización se deben a que se están produciendo simultáneamente otras reacciones muy exergónicas (de las que liberan energía de Gibbs).
Estas reacciones exergónicas son aquellas que liberan mucha energía. Hablando metafóricamente, son solares químicos locales. Esta energía liberada ayuda a la polimerización. Sin Bes, estamos hablando de Adenosin Trifosfato (ATP), que al hidrolizar libera mucha energía libre. Todas las polimerizaciones que se producen en los seres vivos se deben al ATP (Ver Tabla 1). Se puede escribir brevemente:

La molécula de ATP se llama almacenamiento de energía. Es posible que algunas polimerizaciones se produzcan sin ATP, probablemente porque intervienen moléculas equivalentes como la misma.
Si las polimerizaciones actuales se producen gracias al ATP, siendo un mecanismo totalmente universal, ¿cómo se podían producir en la época mencionada? ¿En esta evolución química de la vida ya se había formado el ATP? Estas preguntas, por supuesto, no tienen nada que ver con la termodinámica y nosotros, los químicos, no podemos responderles correctamente. Sin embargo, en esta Tabla 2 se han escrito varias moléculas que pudieron utilizarse como "sol local" y que pueden sintetizarse fácilmente en los ensayos realizados por Miller. ¿Casualidad? Lo que hay que dejar claro es que los procesos de polimerización, es decir, el paso del desorden al orden, pudieron producirse con la ayuda de reacciones que liberan energía libre (o energía de Gibbs).
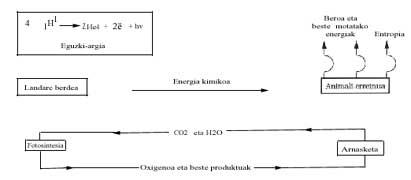
Desde el punto de vista energético, se analiza a continuación el balance energético de la vida actual y sus posibles consecuencias. Sabemos que el Sol emite mucha energía y realiza un largo viaje y realiza "filtros" en la atmósfera terrestre (capa de ozono, etc.) Una vez superada, llega hasta la superficie terrestre. La energía visible se utiliza únicamente en el proceso denominado fotosíntesis, donde se sintetiza la glucosa (C6H1206) de las materias primas CO2 y H2O. A pesar de que el cambio energético de Gibbs es endergónico en esta reacción, la energía suministrada por el Sol permite su realización, según la siguiente ecuación:

Las plantas verdes utilizan por la noche (al anochecer) esta glucosa y la queman con oxígeno para poder llevar a cabo otros procesos de polimerización con la energía liberada. El reino animal aprovecha (come) el trabajo químico de la fotosíntesis de las plantas verdes y obtiene energía gracias a la combustión de glucosa (o de grasa u otras sustancias).
Si esta quema se produjera como la quema de madera o carbón en el fuego, de inmediato se podría deducir que sólo se lograría quemar el "cuerpo", es decir, que la energía liberada en dicha quema rompería los enlaces químicos de los compuestos bioquímicos que se degradarían mediante la administración de C02 y H2O.
La evolución de la vida, Naturaleza, más rápida de lo aquí expuesto, ha sufrido una evolución natural a través de un mecanismo de liberación progresiva de esta energía, que además la acumula como energía química. De nuevo nos viene a la cabeza aquella molécula de ATP.
Los seres vivos consumimos energía para llevar a cabo diferentes tipos de trabajo, es decir, procesos que no se producirían por sí mismos según lo definido por la termodinámica clásica macroscópica. Estos procesos podemos expresarlos como:
- Los oligoelementos y materias primas, es decir, la “comida”, deben ser transportados, transportados y transportados a todas las células que componen la entidad viva. Para ello hay que trabajar y esta concentración y/o transporte no es nada fácil. ¿Os habéis preguntado alguna vez qué cansancio tiene que tener subir el agua y las sales de las raíces hasta la cima de un árbol?, ¿o cómo es el bombeo que tiene que hacer el corazón para enviar sangre hasta el dedo y la energía que consume? Hay que transportar y concentrar muchas cosas en los cuerpos.
- Además, se necesita mucha energía para polimerizar, por ejemplo, para sintetizar moléculas de ADN que tienen la capacidad de transmitir a sus descendientes información genética de sus antepasados. Es decir, para asegurar la supervivencia de la vida se necesita energía. (En definitiva, seguimos vivos porque nos alimentamos a corto plazo, pero sólo si nos reproducimos como especie a largo plazo).
- Por último, realizamos algunos trabajos físicos como la contracción de los músculos… y cualquier trabajo que desprenda calor. Es decir, el calor que desprende el ser vivo, el que absorbe el
medio y por tanto aumenta la entropía local. Por ello, en este proceso natural, vivo, va aumentando la entropía o el desorden del universo.
De acuerdo con lo anterior, se puede afirmar que: Que la aparición y desarrollo de la vida en el planeta Tierra no son procesos contrarios al segundo principio de la termodinámica. Nosotros hemos querido explicar uno de ellos que cumple el principio. Si decimos que la verdad es redonda, deberíamos reconocer que no hemos hecho más que una aproximación, y en las líneas que siguen trataremos de ponerla de manifiesto.
Por un lado, la termodinámica clásica macroscópica utilizada predice los cambios que pueden producirse en los sistemas macroscópicos equilibrados y así se ha aplicado a la célula. Sin embargo, reflexionando nos daremos cuenta de la debilidad de esta aproximación. Sabemos que la célula es algo muy microscópico. Por lo tanto, las concentraciones macroscópicas y las concentraciones en ellas pueden ser muy diferentes. Es más, la célula no es un sistema aislado, sino abierto, como se ha mencionado anteriormente, por lo que es un sistema no equilibrado y no equilibrado. Sin embargo, la concentración de gran cantidad de materias primas se mantiene prácticamente constante a lo largo del tiempo. Por eso a esta situación se le llama estado estacionario (falso equilibrado).
La aparición de la vida ha sido, básicamente, un proceso natural y por tanto irreversible. En este caso sería mucho más apropiado utilizar una termodinámica irreversible que la termodinámica clásica, cuya descripción queda fuera de este artículo.
En la Universidad de Chicago S. Miller y H. Esquema del utillaje utilizado por Urey. Sus condiciones experimentales se simulaban en la Tierra primitiva. Desde la llave de la izquierda se introdujo una atmósfera de gases redactores, que se excitaba con una fuerte chispa eléctrica (en aquella época puede considerarse energía emitida por el Sol). El agua del matraz inferior se calentaba (en aquella época se consideraba que la Tierra estaba muy caliente) y se enfriaba mediante un condensador cayendo en forma de gota de lluvia. Los compuestos disueltos en estas gotas de agua se acumulaban en la parte inferior y con la llave de la misma se extraían periódicamente muestras.
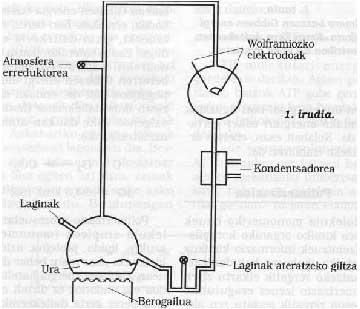
El 15% de todo el carbono metano introducido en estas sesiones se había convertido en un compuesto bioquímico, como la glicina, la alanina, el ácido glutámico, la urea, etc. (al menos una veintena de compuestos diferentes) y otro gran porcentaje en forma de arena alquitranada. Es sorprendente que la mayoría de los aminoácidos que forman las proteínas se puedan conseguir en estas sesiones y más aún en la mayoría de los compuestos que sustentan la vida. ¿Es pura casualidad o la vida pudo aparecer con la evolución de estos compuestos?