Luz gratis

La fluorescencia y la fosforescencia no son lo mismo, pero la diferencia no es grande. En ambos casos, la materia absorbe y emite luz. En el caso de la fluorescencia esto ocurre en muy poco tiempo, en algunos microsegundos. En el caso de la fosforescencia, el tiempo que puede abarcar este proceso es muy amplio: milisegundos, minutos e incluso horas. Por ello, en el caso de la fosforescencia, aunque no existan otras fuentes de luz, la materia puede seguir emitiendo luz.
Luz propia
Plinio Zaharra habló sobre unas piedras preciosas con luz propia. Pero XVII. A principios del siglo XX, otra piedra singular despertó el verdadero interés científico. Vincenzo Casciarolo, zapatero y alquimista, encontró en las proximidades de Bolonia una piedra de sulfato de bario que luego se conocería como la piedra boloñesa. Y allí descubrió que si se mantenía a la luz del sol emitía después una luz extraña en la oscuridad. Esto despertó la imaginación de los alquimistas de la época. Y es que, en aquella época, los alquimistas buscaban la piedra de los filósofos que serviría para hacer oro, y por supuesto, una piedra mágica de estas características era muy esperanzadora.
Aunque no tuvo éxito como piedra de los filósofos, la curiosidad por la piedra bolónica no desapareció. El propio Galileo también participó en los debates científicos sobre esta piedra. Por ejemplo, cuando Fortunius Licetus escribió que la luz de la luna era la misma que la de la piedra bolónica, Galileo se opuso alegando que la luz de la luna era la luz reflejada del sol.

Sobre esta piedra se realizaron multitud de investigaciones, a la vez que muchos investigadores fueron descubriendo otras sustancias de similares propiedades. Todas se volvían luminosas, después de la luz o calentadas, etc. Por ello se les denominó phosphés, es decir, luminosos o porta-luz. Y hoy en día conocemos como fosforescencia aquel fenómeno mágico observado por el zapatero Casciarolo en la piedra bolónica.
A pesar de tratarse de un fenómeno muy similar a la fosforescencia, la fluorescencia fue encontrada mucho más tarde: XIX. En el siglo XX. Aunque por primera vez lo vieron en una solución de clorofila, Sir George Gabriel Stokes (a quien se debe buena parte de lo que hoy sabemos sobre este tema) tomó el nombre del fenómeno de la fluorita.
A nivel atómico
Para comprender estos dos fenómenos es necesario descender al nivel de los átomos. Básicamente, cuando un fotón --o radiación electromagnética - toca un átomo, éste toma la energía del fotón y se excita. Y cuando el átomo vuelve a su estado inicial relajado, emite otro fotón, normalmente de menor energía.

Supóngase que un electrón excitado ha pasado del nivel básico de energía S 0 al nivel S 1. Pero dentro de estos principales niveles energéticos hay otros niveles. Así, por ejemplo, es posible que el electrón suba hasta el tercer nivel de S 1. Inmediatamente, este electrón tenderá a descender al nivel mínimo de S 1 y perderá algo de energía en este camino en forma de calor. A continuación, el electrón bajará al nivel básico (S 0) y si en ese camino la energía que pierde sale como fotón, estaremos ante un caso de fluorescencia.
El resultado de este proceso es que el átomo que recibe la radiación de una determinada longitud de onda absorbe esa primera radiación y emite una radiación de mayor longitud de onda, y por tanto de menor energía. Esta es la base de la fluorescencia.
Los niveles energéticos de los átomos son discretos y requieren una cantidad determinada de energía para pasar de uno a otro. Por ello, sólo absorben fotones con esta cantidad de energía. Por tanto, los materiales fluorescentes y fosforescentes emiten luz sólo con una radiación de una determinada longitud de onda, y a su vez, la luz que emiten será de una determinada longitud de onda. O, más concretamente, de un rango concreto de longitudes de onda. De hecho, dentro del nivel energético básico no siempre se caen los electrones al mismo nivel. Y, por tanto, no toda la radiación emitida será de la misma longitud de onda. La longitud de onda en la que se produce la absorción y la emisión depende de los componentes y del estado del material.

Como la radiación emitida es menor que la absorbida, para que la emitida tenga un espectro visible, normalmente los átomos deben aspirar a los rayos ultravioleta. Por ello, la fluorescencia suele aparecer en la mayoría de los casos bajo radiación ultravioleta. Sin embargo, lo absorbido y lo emitido también pueden pertenecer al mismo espectro, y a veces también cuesta separarlos.
Vía prohibida
En el caso de la fosforescencia el proceso es muy similar. Pero los electrones excitados quedan 'atrapados' en otra situación especial. De hecho, en este caso, se dice que el paso de este peculiar estado a un nivel de energía básico está cuanticamente prohibido. Esto no significa que no se pase, pero la probabilidad es mucho menor. Por ello, el proceso se alarga y, tras eliminar la fuente de radiación, el material fosforescente sigue emitiendo luz.
Sin embargo, la mayoría de los fosforescentes son emisores relativamente rápidos que emiten luz en unos milisegundos. En el caso de otros, sin embargo, el proceso puede alargarse mucho: minutos e incluso horas, por lo que suelen ser materiales que dan luz en el oscuro. Este es el caso de la piedra boloñesa. Y eso es también lo que ocurre en las agujas y números de muchos relojes, o para pegarse en el techo en esas estrellas y planetas, etc.
Pero la fosforescencia tiene otra aplicación muy utilizada. Lo que vemos en las televisiones convencionales o en las pantallas de los ordenadores de sobremesa es precisamente la fosforescencia, si estas pantallas funcionan por medio de un tubo de rayos catódicos. En estas pantallas se utilizan tres componentes fosforescentes para crear imágenes coloreadas: el sulfuro de zinc se combina con el cobre y el aluminio, obteniendo un componente de color verde; para el azul, el sulfuro de zinc se mezcla con un poco de plata; y por último, el color rojo se obtiene activando el sulfuro de óxido de itrio con el europeo.

En casa, discoteca y laboratorio
La fluorescencia es, en la actualidad, totalmente domesticada. De hecho, es muy habitual el uso de tubos fluorescentes para la iluminación de cualquier tipo de edificio. Estos tubos contienen mercurio en su interior y las paredes del tubo un recubrimiento fluorescente por su interior. Cuando se produce una descarga eléctrica entre los electrodos del tubo, los electrones excitan a los átomos de mercurio y éstos emiten radiación ultravioleta.
Esa radiación no es visible, y si sólo eso ocurriera, no veríamos la luz. Pero esta radiación ultravioleta emitida por los átomos de mercurio excitados excita a su vez a los átomos del revestimiento fluorescente del tubo, que emiten la luz visible que sale del tubo fluorescente.
Y la cadena de átomos que se excitan puede ser más larga. De hecho, otras lámparas fluorescentes se utilizan simultáneamente para producir fluorescencia. Son similares a los tubos fluorescentes convencionales, pero con diferente cobertura, y emiten un poco de luz visible y, sobre todo, una radiación ultravioleta cercana, llamada “luz negra”.
Esta radiación ultravioleta cercana suele ser de una longitud de onda superior a 350 nm, muy próxima al espectro visible, por lo que no tiene efectos adversos sobre los rayos ultravioletas de menor longitud de onda. Estas lámparas se utilizan para resaltar materiales fluorescentes en la oscuridad. Por ejemplo, son habituales en las discotecas para inducir la fluorescencia del poliéster que suele estar presente en los tejidos blancos.
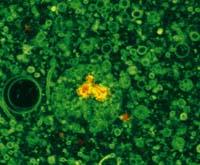
Además de en casa y discoteca, en los laboratorios también es importante la fluorescencia. La fluorescencia tiene muchas aplicaciones en la ciencia. Es muy utilizado en bioquímica y medicina para detectar moléculas, células o tejidos. Algunas moléculas pueden presentar fluorescencia propia, pero en muchos casos se utilizan marcas fluorescentes --fluoroforos- para marcar lo que se pretende detectar.
Por ejemplo, mediante la adición de un fluoroforo a los anticuerpos, se puede localizar en una muestra el antígeno de este anticuerpo. Para ello se utilizan microscopios de fluorescencia. Estos microscopios iluminan la muestra con rayos ultravioleta que permiten la observación visual de la fluorescencia o mediante un monitor.

La fluorescencia tiene cada año más aplicaciones a nivel científico. Pero hemos visto que en la vida cotidiana la fluorescencia y la fosforescencia son más comunes de lo que podríamos pensar en un principio. Si estás usando uno o los dos para leer, no sé, pero para escribir este artículo los dos fueron imprescindibles.





