Metano: só fonte de enerxía?
A activación do enlace C-H do metano a nivel industrial, en condicións áxiles de reacción, é un dos retos máis importantes da química actual. De feito, si esta activación fose posible, o metano sería un dos compostos químicos máis utilizados, non só na produción de enerxía, senón na obtención de hidróxeno molecular e na síntese de compostos químicos máis valiosos como alcois ou hidrocarburos máis grandes.
En xeral, cando falamos de activación de alcanos saturados, formados por enlaces C-C e C-H, estamos a falar de romper controladamente un dos seus enlaces C-C ou C-H. Este é o primeiro obstáculo a superar en moitos dos usos destes compostos. Estes procesos, con todo, son altamente custosos desde o punto de vista enerxético en condicións de reacción convencionais, limitando o uso actual dos alcanos saturados á produción enerxética por combustión principalmente. Este uso explota a capacidade enerxética destes compostos, pero non a posibilidade de obter compostos máis útiles e valiosos a partir deste composto.
Na medida en que o metano, CH 4, é o máis pequeno dos alcanos saturados, pódese dicir que a súa activación ten certas particularidades. Por unha banda, na medida en que o catro hidróxenos do metano son equivalentes, a súa activación non leva problemas de selectividade habituais nestes casos, xa que o produto será o mesmo. Doutra banda, sendo enlácelos C-H máis fortes nos alcanos os dos carbonos das esquinas, está claro que o metano é un caso extremo.
Así mesmo, paira comprender a importancia da activación deste composto, principal compoñente do gas natural, convén ter en conta a súa orixe. De feito, o metano aparece como un produto de descomposición anaeróbica da materia orgánica e do metabolismo dos microorganismos metanogénicos, polo que existen no mundo grandes reservas naturais de metano, estimándose que a cantidade mundial de metano é o dobre que os residuos fósiles.
Gran parte destas reservas naturais concéntranse en chans de océanos e lagos como hidratos de metano. Por iso, o metano coñécese a miúdo como o gas dos lagos. Estes hidratos de metano son clatratos de metano formados en condicións de baixa temperatura e alta presión, estruturas abertas formadas por moléculas de auga que albergan una molécula de metano.
Estímase que máis da metade do metano e o gas natural atópanse en estado metano-hidrato a nivel mundial. Así, moitos países están a investigar e estudando a posibilidade de utilizar este hidrato de metano como combustible.
Ademais dos chans dos océanos e lagos, nas primeiras capas da cortiza terrestre existen grandes reservas de metano adsorbidas nas veas de carbón. Así, en moitos países utilízase este metano paira reducir a dependencia do petróleo. No entanto, o uso deste metano tamén leva riscos. Isto débese a que é necesario utilizar grandes cantidades de auga paira reducir a presión e liberar o gas dos poros. Isto, ademais de reducir os niveis de auga dos acuíferos, pode provocar contaminación da auga.
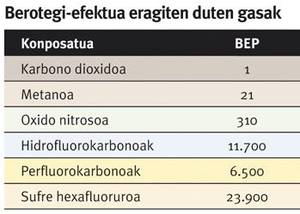
Ademais dos dous riscos mencionados, na actualidade existe outro que adquiriu una gran atención. De feito, o potencial efecto invernadoiro do metano (PIR) é 21 veces maior que o do dióxido de carbono. Por iso, na explotación dos diferentes tipos de provisións naturais de metano é necesario adoptar medidas paira evitar a fuga de gases á atmosfera, o que podería incrementar o cambio climático.
Neste sentido, en moitas zonas gandeiras, vertedoiros e depuradoras con alta produción de metano, en lugar de liberar á atmosfera o metano xerado, recóllese e utilízase na produción de enerxía. Desta forma, con todo, xérase dióxido de carbono, principal responsable do cambio climático a pesar de ter un PIR inferior ao metano. A activación do metano pode ser a clave paira solucionar este problema.
O potencial efecto invernadoiro (PEP) reflicte a capacidade dun gas paira provocar o efecto invernadoiro. Utilízase como referencia o dióxido de carbono, e o valor PIR dun gas indica o número de veces que una determinada concentración mantén a calor do sol na atmosfera por encima da mesma concentración de dióxido de carbono.
Buscando os catalizadores máis adecuados
Volvendo á activación do metano, paira reducir as necesidades enerxéticas asociadas á rotura da súa enlace C-H, utilízanse catalizadores no laboratorio. De feito, na maioría das investigacións actuais utilízanse compostos de metais de transición que aparecen no bloque central da táboa periódica. Dicimos compostos porque os metais de transición poden utilizarse de diferentes formas: como átomos neutros, como cationes, como clústeres ou como estruturas de varios átomos de metal, ou como átomos de metal unidos a outros elementos non metálicos. Precisamente, no camiño cara á activación do metano industrial, a clave está en atopar o catalizador máis adecuado.
Os metais de transición adoitan ter outras estruturas posibles próximas á estrutura ou estado electrónico do seu nivel enerxético máis baixo, é dicir, á forma de distribuír os electróns a través da molécula, e á hora de investigar a activación de metano con estes catalizadores é necesario ter en conta estas situacións. Isto débese a que, a pesar de que una situación electrónica atópase a un nivel de enerxía superior ao outro, é posible que teña una estabilidade suficiente e que neste caso a reacción prodúzase.
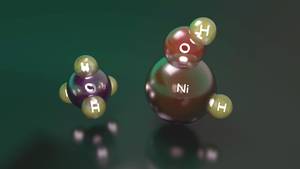
Un exemplo claro diso é a reacción entre o níquel hídrido hidróxido catión e metano. En efecto, aínda que este composto pode activar o metano, cando se atopa no seu estado máis baixo de enerxía, parece un complexo entre o níquel catión e a auga que non ten a capacidade de activalo. Pola contra, cando o nivel enerxético é maior, a cantidade de enerxía que necesita o hidróxeno paira pasar do níquel ao osíxeno é maior, polo que ten una estabilidade suficiente como paira activar o metano antes de proporcionar un complexo inreactivo entre o níquel catión e a auga.
Aínda que o reactivo deste segundo estado ten un nivel de enerxía superior ao do primeiro estado, é capaz de mantelo nese estado electrónico. Con todo, ao chegar a un intermediario da vía de reacción, ambas as situacións convértense en intercambiables e, ao pasar da situación inicial á estable, prodúcese un complexo entre o catión de níquel e a auga, terminando a reacción. Por iso, aínda que o níquel hídrido hidróxido catión é capaz de activar o metano, conséguese un rendemento de reacción moi baixo, é dicir, dos reactivos que inician a reacción só uns poucos conseguen activar o metano.
A medida que descendemos na Táboa Periódica, a estabilidade do estado máis baixo de enerxía aumenta. Nesta situación, no caso do platino que é o átomo máis grande do grupo do níquel, pode pensarse que os platinos hidróxido e sulfhídrido cationes (HP tOH+ e HP tSH+) poden reaccionar co metano, xa que se demostrou que son suficientemente estables no seu estado fundamental.
Tendo en conta o exemplo do catión níquel hídrido hidróxido, e sendo posible a activación do metano na situación máis baixa da enerxía, estímase que aumenta a probabilidade de obter maiores rendementos de reacción. De feito, neste caso non é posible pasar a un estado no que o sistema presenta un nivel de enerxía inferior e non presenta una estabilidade suficiente paira reaccionar co metano.
Paira asegurar que estes compostos de platino activan o metano, habería que investigar esta reacción en por si, xa que é posible que estes dous catalizadores non sexan suficientes paira activar o metano. A pesar de que este estudo non se levou a cabo aínda, é coñecido que o catión de platino activa o metano en condicións de reacción leves, e observouse que a adición a un metal de transición de grupos de hidrido (-H), hidróxido (-OH) ou sulfhídrido (-SH) aumenta a reactividad do metal respecto ao metano. Por tanto, estes compostos poden ser adecuados paira seguir investigando.
Paira terminar, descartaremos exemplos concretos e volveremos ao problema do cambio climático. Nas reaccións entre estes metais de transición compostos e o metano a miúdo libérase hidróxeno molecular. Así, como se comentou anteriormente, se a activación do metano fose posible, o metano podería ser utilizado como fonte de H2, e ao tratarse dun combustible que non xera dióxido de carbono, isto permitiría obter un combustible "limpo" a partir dun composto cun alto potencial de efecto invernadoiro.