Metanoa: energia-iturria soilik?
Industria mailako metanoaren C-H loturaren aktibazioa, erreakzio-baldintza arinetan, gaur egungo kimikak duen erronkarik garrantzitsuenetako bat da. Izan ere, aktibazio hori posible izango balitz, metanoa konposatu kimikorik erabilienetakoa izango litzateke, ez bakarrik energia-produkzioan; hidrogeno molekularra lortzeko eta konposatu kimiko baliotsuagoak sintetizatzeko, hala nola alkoholak nahiz hidrokarburo handiagoak, erabili ahalko litzateke.
Oro har, C-C eta C-H loturez osaturik dauden alkano aseen aktibazioaz hitz egiten dugunean, beren C-C edo C-H loturetako bat era kontrolatuan apurtzeaz ari gara. Hain zuzen ere, hori da konposatu horien erabilera askotan gainditu beharreko lehen oztopoa. Prozesu horiek, ordea, energia-ikuspegitik oso garestiak dira ohiko erreakzio-baldintzetan, eta, ondorioz, alkano aseen gaur egungo industria mailako erabilera nagusiki konbustio bidezko energia-produkziora mugatzen da. Erabilera horrek konposatu horien gaitasun energetikoa ustiatzen du; ez, ordea, konposatu horretatik abiatuta konposatu erabilgarri eta baliotsuagoak lortzeko aukera.
Metanoa, CH 4 , alkano aserik txikiena den heinean, haren aktibazioak berezitasun batzuk dituela esan daiteke. Alde batetik, metanoaren lau hidrogenoak baliokideak diren heinean, haien aktibazioak ez dakar halakoetan ohikoak izaten diren selektibitate arazorik, hidrogeno bat edo bestea aktibatu, produktua berdina izango baita. Bestetik, alkanoetan C-H lotura sendoenak ertzetako karbonoenak izanik, argi dago metanoa muturreko kasu bat dela.
Halaber, gas naturalaren osagai nagusia den konposatu honen aktibazioaren garrantzia ulertzeko, haren jatorria kontuan hartzea komeni da. Izan ere, metanoa materia organikoaren deskonposaketa anaerobikoko nahiz mikroorganismo metanogenikoen metabolismoko produktu gisa agertzen da, eta, hortaz, munduan metano-erreserba natural handiak daude; munduko metano-kantitatea hondakin fosilen halako bi dela kalkulatzen da.
Erreserba natural horien zati handi bat ozeano nahiz lakuetako lurzoruetan pilatzen da, metano-hidrato gisa. Hori dela eta, metanoa lakuetako gas izenez ezagutzen da sarritan. Metano-hidrato horiek tenperatura baxuko eta presio altuko kondizioetan osatzen diren metano-klatratoak, metano-molekula bat gordetzen duten ur-molekulaz osaturiko egitura irekiak, dira.
Mundu mailako metanoaren nahiz gas naturalaren erdia baino gehiago metano-hidrato egoeran dagoela uste da. Hala, herrialde asko ari dira metano-hidrato hori erregai gisa erabiltzeko aukera aztertzen eta horretarako ikerketak bultzatzen.
Ozeano eta lakuetako lurzoruetan ez ezik, lurrazaleko lehen geruzetan ere metano-erreserba handiak daude, ikatz-zainetan adsorbatuta. Hala, herrialde askotan metano hori erabiltzen da, petrolioarekiko mendekotasuna murrizteko. Dena den, metano horren erabilerak ere baditu bere arriskuak. Izan ere, ur-kantitate handiak erabili behar izaten dira presioa txikitu, eta gasa poroetatik askatzeko. Horrek, akuiferoetako ur-mailak jaisteaz gain, uraren kutsadura ere eragin dezake.
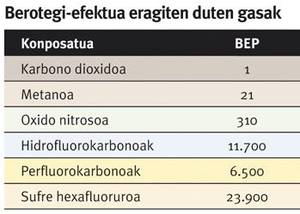
Aipaturiko bi arrisku horiez gain, bada gaur egun arreta handia bereganatu duen beste bat. Izan ere, metanoaren berotegi-efektu potentziala (BEP) karbono dioxidoarena baino 21 aldiz handiagoa da. Hori dela eta, era bateko zein besteko metano-hornidura naturalak ustiatzeko garaian, nahitaezkoa da gasak atmosferara ihes egitea saihesteko neurriak hartzea, horrek klima-aldaketa areagotu bailezake.
Ildo horretatik, metano-produkzio handia duten abeltzaintza-eremu, zabortegi nahiz araztegi askotan, sorturiko metanoa atmosferara askatu beharrean, bildu eta energia-produkzioan erabiltzen da. Era horretan, ordea, metanoa baino BEP txikiagoa izanagatik klima-aldaketaren erantzule nagusia den karbono dioxidoa sortzen da. Hain zuzen ere, metanoaren aktibazioa izan liteke arazo horri konponbidea aurkitzeko giltza.
Berotegi-efektu potentzialak (BEP) gas batek berotegi-efektua eragiteko duen gaitasuna islatzen du. Erreferentzia gisa karbono dioxidoa erabiltzen da, eta gas baten BEP balioak adierazten du haren kontzentrazio jakin batek karbono dioxidoaren kontzentrazio berberak baino zenbat aldiz gehiago mantentzen duen eguzkitiko beroa atmosferan.
Katalizatzaile egokienen bila
Metanoaren aktibaziora itzuliz, haren C-H loturaren hausturak dakartzan energia-beharrak murrizteko, katalizatzaileak erabiltzen dira laborategian. Hain zuzen, gaur egungo ikerketa gehienetan, taula periodikoan erdiko blokean azaltzen diren trantsizio-metalez osaturiko konposatuak erabiltzen dira. Konposatuak diogu, trantsizio-metalak modu ezberdinetan erabil daitezkeelako: atomo neutro gisa, katioi gisa, kluster edo hainbat metal-atomotako egitura gisa, edo metal-atomoak beste elementu ez-metaliko batzuei lotuta. Hain zuzen, industria mailako metanoaren aktibazioa lortzeko bidean, gakoa katalizatzailerik egokiena aurkitzean datza.
Trantsizio-metalek beren energia-maila baxueneko egitura edo egoera elektronikotik, hau da, molekulan zehar elektroiak banatzeko modutik gertu dauden beste egitura posible batzuk izan ohi dituzte, eta, katalizatzaile horien bidezko metano-aktibazioa ikertzeko garaian, beharrezkoa da egoera horiek ere kontuan hartzea. Izan ere, egoera elektroniko bat bestea baino energia-maila altuagoan egon arren, baliteke aski egonkortasun izatea, eta, kasu horretan, gerta daiteke erreakzioa egoera horretan gertatzea.
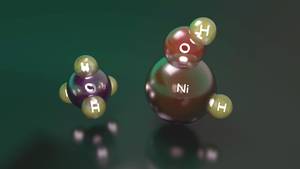
Aipatutakoaren adibide garbi bat da nikel hidrido hidroxido katioiaren eta metanoaren arteko erreakzioa. Izan ere, konposatu horrek metanoa aktiba badezake ere, bere energia-mailarik baxueneko egoeran dagoenean, metanoa aktibatzeko gaitasunik ez duen nikel katioiaren eta uraren arteko konplexua ematen du. Energia-maila handiagoa duenean, aldiz, hidrogenoak nikeletik oxigenora igarotzeko behar duen energia-kantitatea handiagoa izaki, nikel katioiaren eta uraren arteko konplexu ez-erreaktiboa eman aurretik, metanoa aktibatzeko adina egonkortasun dauka.
Bigarren egoera horretako erreaktiboak lehenengo egoerakoak baino energia-maila handiagoa badu ere, egoera elektroniko horretan mantentzeko gai da. Erreakzio-bideko bitartekari batera iristean, ordea, bi egoerak trukagarriak bihurtzen dira, eta hasierako egoeratik egoera egonkorrera igarotzean, nikel-katioiaren eta uraren arteko konplexua sortzen da, eta erreakzioa amaitu egiten da. Hori dela eta, nikel hidrido hidroxido katioia metanoa aktibatzeko gai izan arren, oso erreakzio-etekin txikia lortzen da, alegia, erreakzioa hasten duten erreaktiboetatik, gutxi batzuek baino ez dute lortzen metanoa aktibatzea.
Taula periodikoan behera egiten dugun heinean, energia-mailarik baxueneko egoeraren egonkortasuna handitu egiten da. Egoera horretan, nikelaren taldeko atomorik handiena den platinoaren kasuan, pentsa daiteke platino hidrido hidroxido nahiz sulfhidrido katioiek (HPtOH+ eta HPtSH+) metanoarekin erreakziona dezaketela, beren oinarrizko egoeran aski egonkorrak direla frogatu baita.
Nikel hidrido hidroxido katioiaren adibidea kontuan izanik, eta energia-mailarik baxueneko egoeran metanoaren aktibazioa posible izanik, pentsatzekoa da erreakzio-etekin handiagoak lortzeko probabilitatea handitu egiten dela. Izan ere, kasu honetan ezinezkoa da sistema energia-maila baxuagoa duen eta metanoarekin erreakzionatzeko adinako egonkortasunik ez duen egoera batera pasatzea.
Platino-konposatu horiek metanoa aktibatzen dutela ziurtatzeko, erreakzio hori bere kabuz ikertu beharko litzateke, posible baita bi katalizatzaile horiek metanoa aktibatzeko aski ez izatea. Ikerketa hori oraindik egin ez bada ere, ezaguna da platino-katioiak erreakzio-baldintza arinetan metanoa aktibatzen duela, eta, ikusi denez, trantsizio-metal bati hidrido (-H), hidroxido (-OH) edo sulfhidrido (-SH) taldeak gehitzen zaizkionean, metalaren metanoarekiko erreaktibitatea handitu egiten da. Beraz, konposatu horiek egokiak izan daitezke ikertzen jarraitzeko.
Bukatzeko, adibide zehatzak albo batera utzi eta klima-aldaketaren arazora itzuliko gara. Trantsizio-metal konposatu horien eta metanoaren arteko erreakzioetan, hidrogeno molekularra askatzen da askotan. Hala, aurretik aipatu bezala, metanoaren aktibazioa posible izango balitz, metanoa H2-ren iturri gisa erabili ahal izango litzateke, eta, hidrogenoa karbono dioxidorik sortzen ez duen erregaia izanik, horrek ahalbidetuko luke berotegi-efektu potentzial handia duen konposatu batetik abiatuta erregai "garbi" bat lortzea.
Bibliografia
Idatzi zuk zeuk Gai librean atalean
Gai librean aritzeko, bidali zure artikulua aldizkaria@elhuyar.eus helbidera
Hauek dira Gai librean atalean Idazteko arauak