Visibilizando o invisible: microscopía de expansión
Como se poden observar as estruturas nanoscópicas sen gastar un millón de euros? Os achados de microscopía de punta de punta sempre estiveron ao alcance duns poucos científicos millonarios do momento. Co fin de contrarrestar isto, ocorréuselle a un grupo de individuos que, si non podemos considerar ao microscopio estruturas nanoscópicas, por que non aumentar o seu tamaño? Nace así o que hoxe coñecemos como espantón-microscopía.
XIX. Do mesmo xeito que ocorreu no século XX coa física, hoxe en día son poucos os descubrimentos biolóxicos que se poden facer no mundo macroscópico. Chegaron ao seu fin os días nos que a ensaiada paleontóloga Mary Anning, co seu martelo na man e guiada por unha mera motivación, atopaba decenas de especies desaparecidas nas praias inglesas. Hoxe en día, para comprender os procesos biolóxicos que rexen as nosas vidas e realizar avances significativos no campo da bioloxía e o medicamento, debemos analizar organismos, estruturas, moléculas e procesos que non podemos ver a primeira ollada.
O ser humano pode distinguir obxectos de tamaño 0,1 mm. Calquera tamaño é considerado como microscópico e non é visible a primeira ollada. Para iso necesitamos instrumentos que nos axuden a aumentar a imaxe do que queremos observar, os microscopios.
Microscopio óptico XVII. Comezou a utilizarse en Europa no século XX, o que permitiu superar a barreira macroscópica e penetrar no mundo microscópico. Os primeiros microscopios ópticos permitiron localizar protozoos, bacterias e outros microorganismos descoñecidos, cambiando completamente a paradigma da época. Pero como ocorre con moitos descubrimentos científicos, o microscopio óptico trouxo consigo máis preguntas que respostas, xa que no mundo microscópico moitos organismos non teñen cor, son transparentes, polo que tiveron que deseñar métodos de tinguido para poder observalos.
Da mesma maneira, aínda que estas tinturas permitían separar un tecido, célula ou orgánulos doutro, non achegaban moita información en canto ao nivel molecular. Por tanto, como avance das tintas iniciais, XX. na segunda década do século XX desenvolveuse a primeira fluorescencia -microscopio. Este tipo de microscopio utiliza a luz emitida polas moléculas fluorescentes para observar os detalles da mostra.
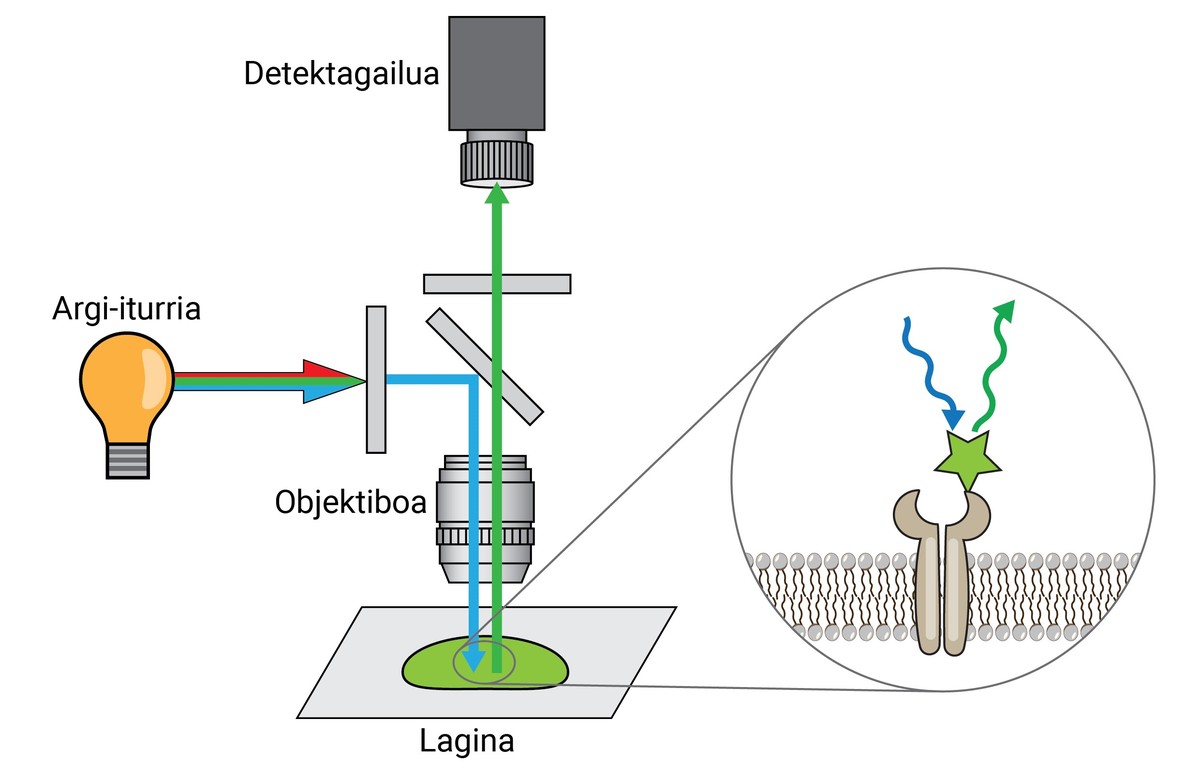
Un microscopio de fluorescencia punta pode separar dúas moléculas ou estruturas a unha distancia igual ou superior a 250 nm, cunha resolución 400 veces maior que a do ollo humano. Isto chámase limite de resolección e é unha das características máis importantes dun microscopio.
Este límite de 250 nm non é suficiente para separar moléculas individuais, polo que na década de 1990 desenvolveuse unha microscopía de superresolución cuxa resolución alcanza os 25 nm [1]. Recentemente conseguiuse reducir este límite até 3 nm coa técnica de superresolución MINFLUX [2]. Esta técnica permite diferenciar estruturas a unha distancia de 3 nm, é dicir, estruturas 25.000 veces máis pequenas que un pelo humano, como moléculas únicas.
Como se pode observar, na historia da microscopía cada vez que rompe unha barreira aparece outra. En moitos casos, estas barreiras foron técnicas (como conseguir unha maior resolución?). ), pero, por exemplo, si chégase ao límite de resolución dunha soa molécula coa técnica MINFLUX, a barreira que se atopou é outra: a barreira económica. Desafortunadamente, ao aumentar a resolución tamén aumenta o custo dos microscopios de superresolución. En xeral, requiren de infraestruturas moi custosas e software sofisticado que só están a disposición duns poucos laboratorios. Por exemplo, un novo microscopio MINFLUX costa 2 millóns de euros.
A maioría dos laboratorios, por tanto, non poden superar esta última barreira e deben conformarse con microscopios convencionais de fluorescencia. Con todo, en 2015, un equipo de investigación atopou a forma de estender a nanoscopia a estes laboratorios, abordando o problema desde outro punto de vista: si o meu microscopio non ten suficiente capacidade para diferenciar a estrutura que quero ver, por que non aumentala? Nace así a expurgo-microscopía [3].
Microscopía de expansión
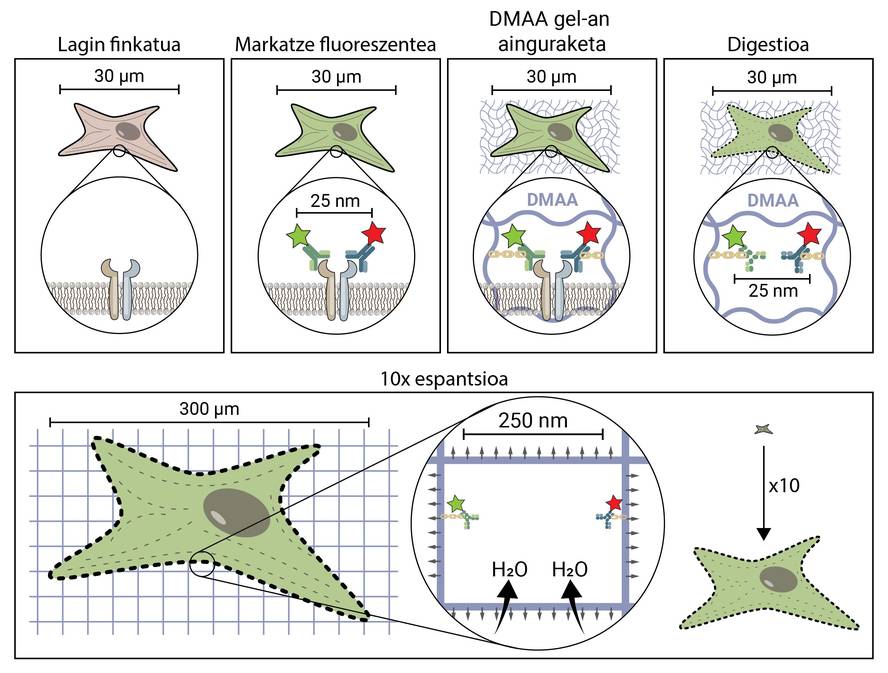
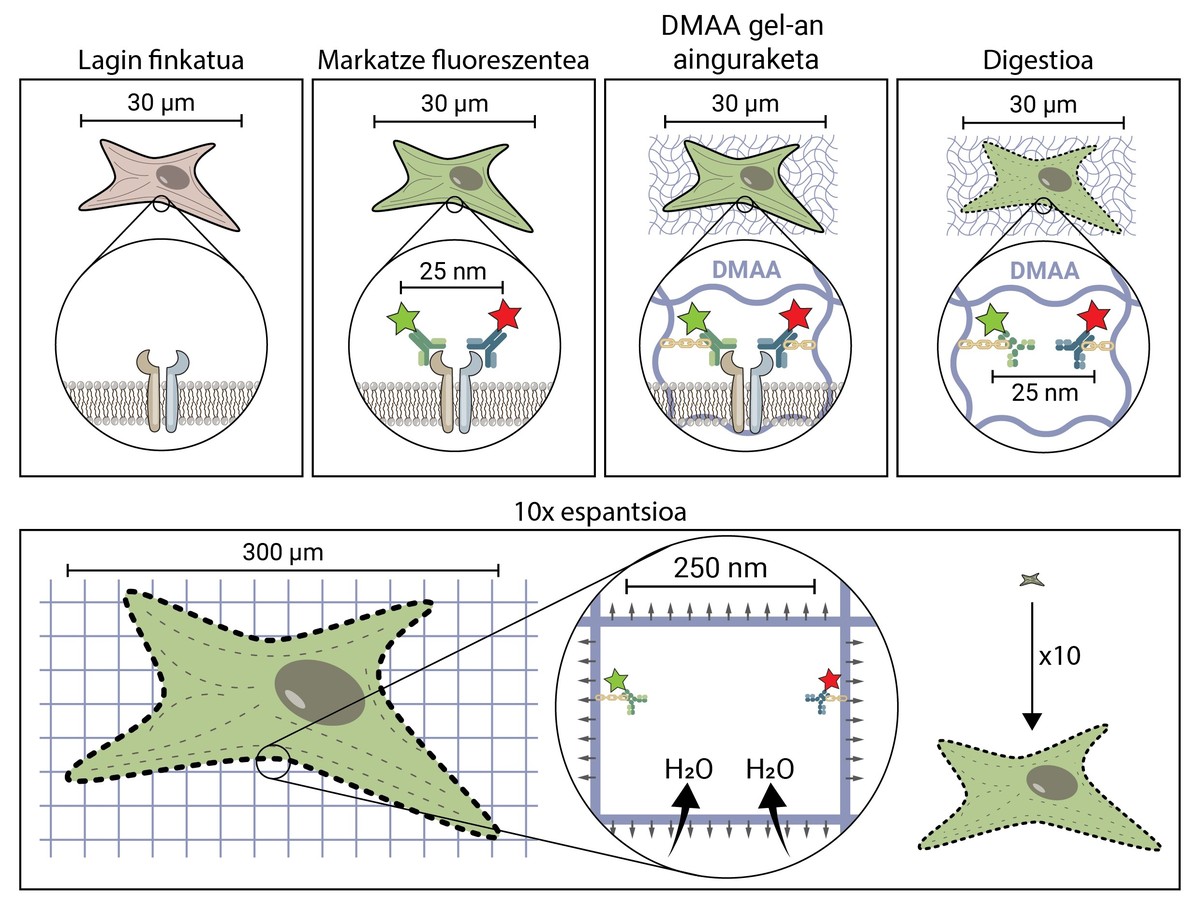
A premisa da microscopía espacial parece conceptualmente bastante sinxela. Pero tecnicamente é complexo. Nunha técnica microscópica tradicional, a mostra márcase con moléculas fluorescentes para observar as estruturas de interese, pero no resto mantense a mostra, polo que mantén a súa forma e tamaño orixinal. Na microscopía de espantsé, para separar estruturas moi pequenas, esténdese a mostra en tres dimensións até alcanzar o tamaño suficiente para ser observada cun microscopio de fluorescencia convencional [4].
Pero, como se propaga unha mostra biolóxica, unha célula, até chegar a ser 10 veces maior que o tamaño orixinal? O segredo está nos cueiros. Os cueiros teñen un xel que absorbe o líquido en contacto coa auga (ou os ouriños), hidratándolo e estendéndoo para evitar a humidade. A microscopia de expansión consiste en empregar un composto similar que se hidrata en contacto coa auga e propágase tridimensionalmente. En concreto, nesta nova técnica utilízase a composta N,N-dimetilacrilamida (DMAA) que polimeriza xunto co acrilato sódico (SA) para formar unha matriz ou xel tridimensional. Este xel deposítase en auga destilada capturando moléculas de auga no seu interior e ten a capacidade de estenderse en tres dimensións até 10 períodos. Con esta propiedade trataríase de estender as estruturas biolóxicas xunto co xel de DMAA [5].
O primeiro que hai que facer é fixar a nosa mostra biolóxica. O proceso de fixación inmobiliza á célula, manténdoa nun momento dado e detendo as reaccións químicas da célula. Así, a célula conxélase no tempo e non degrádase nos seguintes pasos.
Unha vez fixada, a mostra debe marcarse fluorescente, xa que como se dixo, a maioría das estruturas biolóxicas son incoloras. Un dos métodos máis utilizados para a súa obtención é o baseado en anticorpos. Os anticorpos son proteínas que se coñecen e enlazan especificamente con outras moléculas ou estruturas. Si a estes anticorpos adhíreselles un conxugado fluorescente, poden utilizarse para localizar e detectar a molécula que queremos estudar.
Unha vez marcada a mostra por fluorescencia, ancorarase á sala de DMAA. Este proceso de ancoraxe é imprescindible e constitúe un dos pasos máis importantes da microscopía de espantardo, que asegura a propagación da mostra biolóxica xunto coa sala. Nesta ancoraxe, as moléculas fluorescentes que marcan a posición das estruturas de interese únense ao polímero DMAA mediante un enlace covalente. Desta forma, os fluoroforos quedan ligados á aula e manteñen unha posición relativa co resto de fluoroforos.
Unha vez finalizado o proceso de ancoraxe, o xel de DMAA e as moléculas fluorescentes da nosa mostra convértense nunha única entidade, a cal se expande entre si e entre si. Por fin chegou o momento de estender a nosa mostra. Con todo, haberá que facer fronte a un último problema, xa que as células posúen unhas estruturas ríxidas chamadas citoesqueletos e matriz extracelular, que forman unha estada para manter a forma da célula e o tecido e axudar a combater as deformacións mecánicas. Se se tenta a súa difusión a partir deste punto, as forzas de cohesión provocadas por estas estruturas oporanse ás forzas de expansión do xel, rompendo e distorsionando a nosa mostra. Para evitalo hai que dixerir a mostra. Neste proceso dixestivo, a mostra é tratada cunha encima chamada Proteinasa K, que curta e disipa todas as proteínas que compoñen o citoesqueleto e a matriz extracelular, e permite a destrución e expansión da estada que mantén o tamaño celular.
Agora que desfixemos o citoesqueleto e a matriz extracelular, podemos hidratar e estender a nosa habitación. Neste proceso, a molécula de auga absorbe os xeles de DMAA e acumúlanse no seu interior, inflando a habitación como un globo. Dado que o xel de DMAA está formado por unha matriz tridimensional simétrica, a expansión tamén se produce en tres dimensións e a nosa mostra biolóxica está ancorada á sala e propágase con ela. Así, unha célula de 30 micras, para nós invisible, pode estenderse até 10 veces en todas as súas dimensións, até 300 micras (0,3 mm). Moléculas que antes estaban a unha distancia de 25 nm, e que só podían ser separadas por un microscopio de superresolución, agora están a unha distancia de 250 nm e poden ser examinadas en fluorescencia convencional cun microscopio. A microscopia de escritura espacial facilita, por tanto, o acceso ao mundo nanoscópico a quen non poidan realizar investimentos millonarios niso.
A microscopia de expansión, por tanto, proporciona un acceso directo aos descubrimentos daqueles que non temos acceso a software ou aparellos sofisticados, de forma que esta posibilidade non quede en mans duns poucos. Pode dicirse que permite ir máis aló da situación económica dos grupos científicos e que o acceso á información depende das habilidades científicas, como noutras épocas, e non tanto do diñeiro. Así, calquera tema —como no seu día foi Mary Anning— sería capaz de realizar achados tan significativos como o esqueleto do ictiosauro, cuns poucos materiais dispoñibles.
BIBLIOGRAFÍA
[1] Neto Garai JA., Lorizate M. e Contreras FX. 2021. “Shedding lixeiro on membrane rafts structure and dynamics in living cells. Biochimica et biophysica acta. Biomembranes, 1864, 183813.
[2] Balzarotti F., Eilers E. C. Gwosch, Gynna A. Westphal V. Stefani F. Elf J. e Hell S. 2017. “Nanometer resolution imaging and tracking of fluorescent molecules with minimal photon fluxes”. Science 355, 606-612.
[3] Chen F., P. Tillberg W. e Boyden E. S. 2015. “Expansión microscopy”. Science 347, 543–548.
[4] Faulkner E. Thomas S. e Neely R. 2020. “An introduction to the methodology of expansion microscopy”. The International Journal of Biochemistry & Cell Biology, 124, 105764.
[5] Truckenbrodt S., Maidorn M., D. Crzan, Wildhagen H. Kabatas S. e Rizzoli S. 2018. “X10 expansion microscopy enables 25-nm resolution on conventional microscopes”. EMBO reports, 19, e45836.