Visibilizando el invisible: microscopía de expansión
¿Cómo se pueden observar las estructuras nanoscópicas sin gastar un millón de euros? Los hallazgos de microscopía de punta de punta siempre han estado al alcance de unos pocos científicos millonarios del momento. Con el fin de contrarrestar esto, se le ocurrió a un grupo de individuos que, si no podemos considerar al microscopio estructuras nanoscópicas, ¿por qué no aumentar su tamaño? Nace así lo que hoy conocemos como espantón-microscopía.
XIX. Al igual que ocurrió en el siglo XX con la física, hoy en día son pocos los descubrimientos biológicos que se pueden hacer en el mundo macroscópico. Han llegado a su fin los días en los que la ensayada paleontóloga Mary Anning, con su martillo en la mano y guiada por una mera motivación, encontraba decenas de especies desaparecidas en las playas inglesas. Hoy en día, para comprender los procesos biológicos que rigen nuestras vidas y realizar avances significativos en el campo de la biología y la medicina, debemos analizar organismos, estructuras, moléculas y procesos que no podemos ver a simple vista.
El ser humano puede distinguir objetos de tamaño 0,1 mm. Cualquier tamaño es considerado como microscópico y no es visible a simple vista. Para ello necesitamos instrumentos que nos ayuden a aumentar la imagen de lo que queremos observar, los microscopios.
Microscopio óptico XVII. Comenzó a utilizarse en Europa en el siglo XX, lo que permitió superar la barrera macroscópica y penetrar en el mundo microscópico. Los primeros microscopios ópticos permitieron localizar protozoos, bacterias y otros microorganismos desconocidos, cambiando completamente el paradigma de la época. Pero como ocurre con muchos descubrimientos científicos, el microscopio óptico trajo consigo más preguntas que respuestas, ya que en el mundo microscópico muchos organismos no tienen color, son transparentes, por lo que tuvieron que diseñar métodos de teñido para poder observarlos.
De la misma manera, aunque estas tinturas permitían separar un tejido, célula u orgánulos de otro, no aportaban mucha información en cuanto al nivel molecular. Por tanto, como avance de las tintas iniciales, XX. en la segunda década del siglo XX se desarrolló la primera fluorescencia -microscopio. Este tipo de microscopio utiliza la luz emitida por las moléculas fluorescentes para observar los detalles de la muestra.
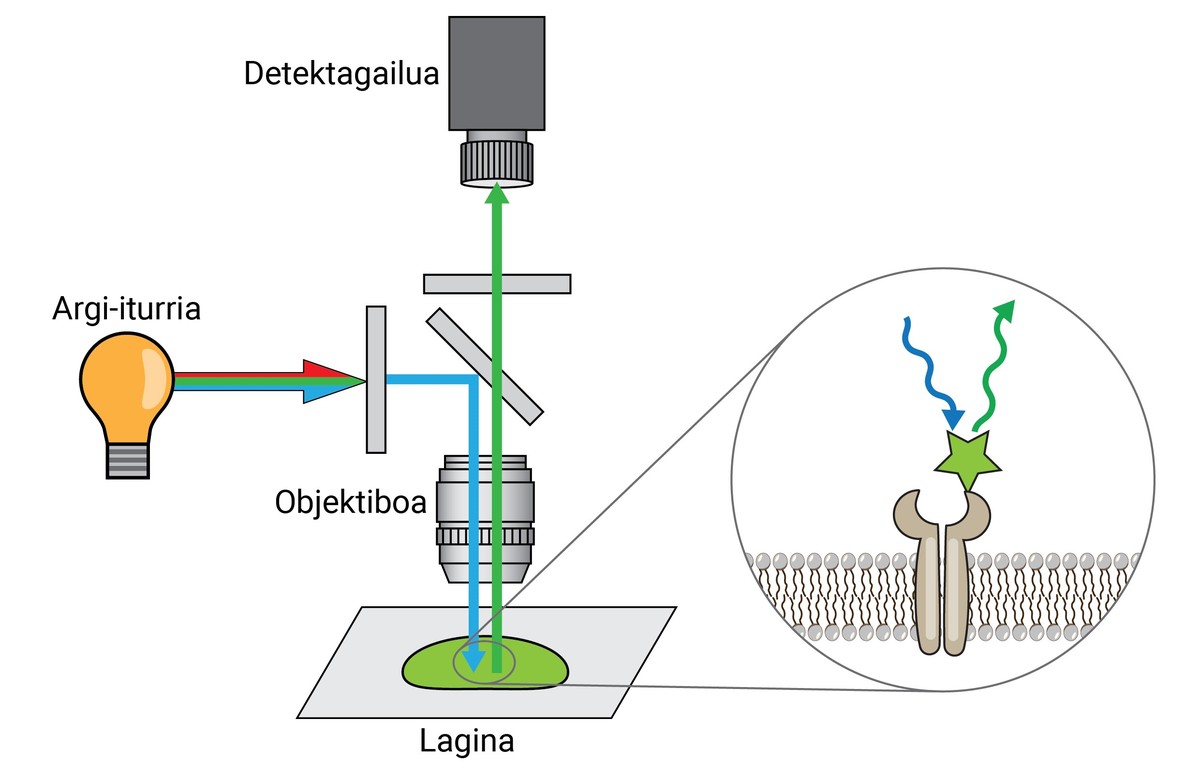
Un microscopio de fluorescencia punta puede separar dos moléculas o estructuras a una distancia igual o superior a 250 nm, con una resolución 400 veces mayor que la del ojo humano. Esto se llama limite de resolección y es una de las características más importantes de un microscopio.
Este límite de 250 nm no es suficiente para separar moléculas individuales, por lo que en la década de 1990 se desarrolló una microscopía de superresolución cuya resolución alcanza los 25 nm [1]. Recientemente se ha conseguido reducir este límite hasta 3 nm con la técnica de superresolución MINFLUX [2]. Esta técnica permite diferenciar estructuras a una distancia de 3 nm, es decir, estructuras 25.000 veces más pequeñas que un pelo humano, como moléculas únicas.
Como se puede observar, en la historia de la microscopía cada vez que se rompe una barrera aparece otra. En muchos casos, estas barreras han sido técnicas (¿cómo conseguir una mayor resolución?). ), pero, por ejemplo, si se llega al límite de resolución de una sola molécula con la técnica MINFLUX, la barrera que se ha encontrado es otra: la barrera económica. Desafortunadamente, al aumentar la resolución también aumenta el coste de los microscopios de superresolución. En general, requieren de infraestructuras muy costosas y software sofisticado que sólo están a disposición de unos pocos laboratorios. Por ejemplo, un nuevo microscopio MINFLUX cuesta 2 millones de euros.
La mayoría de los laboratorios, por tanto, no pueden superar esta última barrera y deben conformarse con microscopios convencionales de fluorescencia. Sin embargo, en 2015, un equipo de investigación encontró la forma de extender la nanoscopia a estos laboratorios, abordando el problema desde otro punto de vista: si mi microscopio no tiene suficiente capacidad para diferenciar la estructura que quiero ver, ¿por qué no aumentarla? Nace así la expurgo-microscopía [3].
Microscopía de expansión
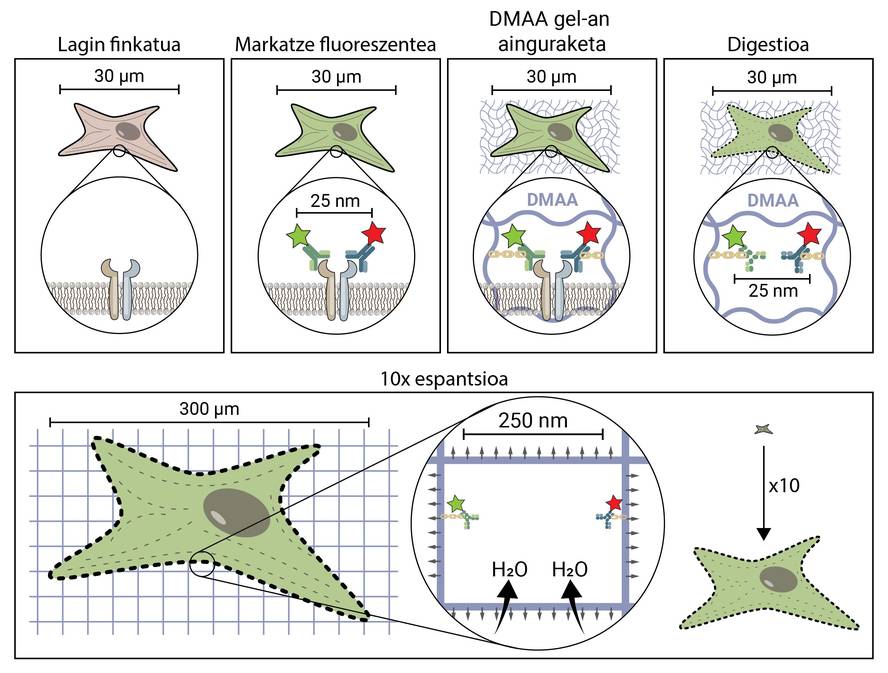
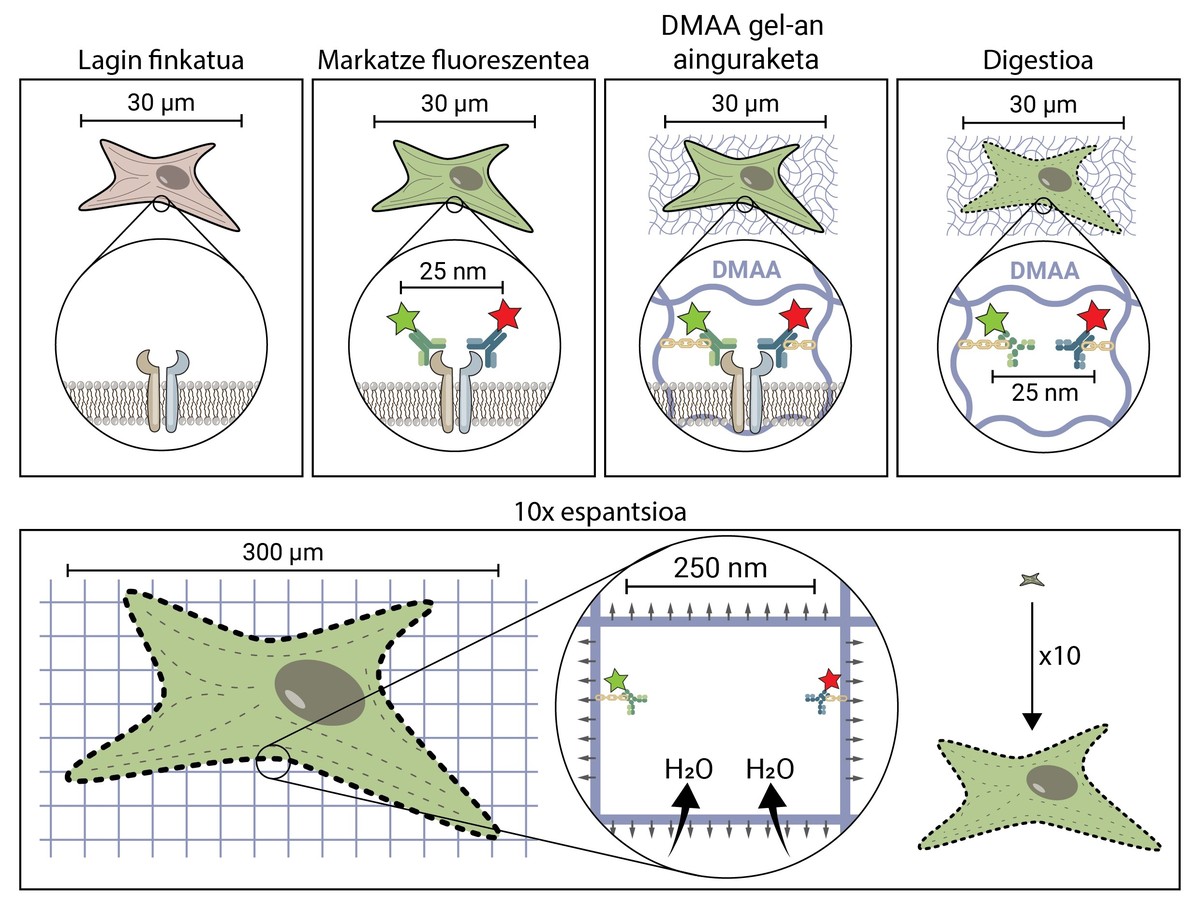
La premisa de la microscopía espacial parece conceptualmente bastante sencilla. Pero técnicamente es complejo. En una técnica microscópica tradicional, la muestra se marca con moléculas fluorescentes para observar las estructuras de interés, pero en el resto se mantiene la muestra, por lo que mantiene su forma y tamaño original. En la microscopía de espantsé, para separar estructuras muy pequeñas, se extiende la muestra en tres dimensiones hasta alcanzar el tamaño suficiente para ser observada con un microscopio de fluorescencia convencional [4].
Pero, ¿cómo se propaga una muestra biológica, una célula, hasta llegar a ser 10 veces mayor que el tamaño original? El secreto está en los pañales. Los pañales tienen un gel que absorbe el líquido en contacto con el agua (o la orina), hidratándolo y extendiéndolo para evitar la humedad. La microscopia de expansión consiste en emplear un compuesto similar que se hidrata en contacto con el agua y se propaga tridimensionalmente. En concreto, en esta novedosa técnica se utiliza la compuesta N,N-dimetilacrilamida (DMAA) que polimeriza junto con el acrilato sódico (SA) para formar una matriz o gel tridimensional. Este gel se deposita en agua destilada capturando moléculas de agua en su interior y tiene la capacidad de extenderse en tres dimensiones hasta 10 períodos. Con esta propiedad se trataría de extender las estructuras biológicas junto con el gel de DMAA [5].
Lo primero que hay que hacer es fijar nuestra muestra biológica. El proceso de fijación inmoviliza a la célula, manteniéndola en un momento dado y deteniendo las reacciones químicas de la célula. Así, la célula se congela en el tiempo y no se degrada en los siguientes pasos.
Una vez fijada, la muestra debe marcarse fluorescente, ya que como se ha dicho, la mayoría de las estructuras biológicas son incoloras. Uno de los métodos más utilizados para su obtención es el basado en anticuerpos. Los anticuerpos son proteínas que se conocen y enlazan específicamente con otras moléculas o estructuras. Si a estos anticuerpos se les adhiere un conjugado fluorescente, pueden utilizarse para localizar y detectar la molécula que queremos estudiar.
Una vez marcada la muestra por fluorescencia, se anclará a la sala de DMAA. Este proceso de anclaje es imprescindible y constituye uno de los pasos más importantes de la microscopía de espantardo, que asegura la propagación de la muestra biológica junto con la sala. En este anclaje, las moléculas fluorescentes que marcan la posición de las estructuras de interés se unen al polímero DMAA mediante un enlace covalente. De esta forma, los fluoroforos quedan ligados al aula y mantienen una posición relativa con el resto de fluoroforos.
Una vez finalizado el proceso de anclaje, el gel de DMAA y las moléculas fluorescentes de nuestra muestra se convierten en una única entidad, la cual se expande entre sí y entre sí. Por fin ha llegado el momento de extender nuestra muestra. Sin embargo, habrá que hacer frente a un último problema, ya que las células poseen unas estructuras rígidas llamadas citoesqueletos y matriz extracelular, que forman un andamio para mantener la forma de la célula y el tejido y ayudar a combatir las deformaciones mecánicas. Si se intenta su difusión a partir de este punto, las fuerzas de cohesión provocadas por estas estructuras se opondrán a las fuerzas de expansión del gel, rompiendo y distorsionando nuestra muestra. Para evitarlo hay que digerir la muestra. En este proceso digestivo, la muestra es tratada con una enzima llamada Proteinasa K, que corta y disipa todas las proteínas que componen el citoesqueleto y la matriz extracelular, y permite la destrucción y expansión del andamio que mantiene el tamaño celular.
Ahora que hemos deshecho el citoesqueleto y la matriz extracelular, podemos hidratar y extender nuestra habitación. En este proceso, la molécula de agua absorbe los geles de DMAA y se acumulan en su interior, inflando la habitación como un globo. Dado que el gel de DMAA está formado por una matriz tridimensional simétrica, la expansión también se produce en tres dimensiones y nuestra muestra biológica está anclada a la sala y se propaga con ella. Así, una célula de 30 micras, para nosotros invisible, puede extenderse hasta 10 veces en todas sus dimensiones, hasta 300 micras (0,3 mm). Moléculas que antes estaban a una distancia de 25 nm, y que sólo podían ser separadas por un microscopio de superresolución, ahora están a una distancia de 250 nm y pueden ser examinadas en fluorescencia convencional con un microscopio. La microscopia de escritura espacial facilita, por tanto, el acceso al mundo nanoscópico a quienes no puedan realizar inversiones millonarias en ello.
La microscopia de expansión, por tanto, proporciona un acceso directo a los descubrimientos de aquellos que no tenemos acceso a software o aparatos sofisticados, de forma que esta posibilidad no quede en manos de unos pocos. Puede decirse que permite ir más allá de la situación económica de los grupos científicos y que el acceso a la información depende de las habilidades científicas, como en otras épocas, y no tanto del dinero. Así, cualquier tema —como en su día fue Mary Anning— sería capaz de realizar hallazgos tan significativos como el esqueleto del ictiosauro, con unos pocos materiales disponibles.
BIBLIOGRAFÍA
[1] Nieto Garai JA., Lorizate M. y Contreras FX. 2021. “Shedding light on membrane rafts structure and dynamics in living cells. Biochimica et biophysica acta. Biomembranes, 1864, 183813.
[2] Balzarotti F., Eilers Y. C. Gwosch, Gynna A. Westphal V. Stefani F. Elf J. y Hell S. 2017. “Nanometer resolution imaging and tracking of fluorescent molecules with minimal photon fluxes”. Science 355, 606-612.
[3] Chen F., P. Tillberg W. y Boyden E. S. 2015. “Expansión microscopy”. Science 347, 543–548.
[4] Faulkner E. Thomas S. y Neely R. 2020. “An introduction to the methodology of expansion microscopy”. The International Journal of Biochemistry & Cell Biology, 124, 105764.
[5] Truckenbrodt S., Maidorn M., D. Crzan, Wildhagen H. Kabatas S. y Rizzoli S. 2018. “X10 expansion microscopy enables 25-nm resolution on conventional microscopes”. EMBO reports, 19, e45836.