Sumando fuerzas en la lucha contra el cáncer de hígado
Ingeniaritza Aplikatuan doktorea eta TECNUN - Nafarroako Unibertsitateko irakasle eta ikertzailea
Según la mitología griega, Prometeo robó el fuego del monte Olinpo y lo entregó a los humanos. Entonces, Zeus lo castiga, lo ató en una roca y durante una temporada envió un águila a comer todas las noches los trozos de su hígado. Sin embargo, a la mañana siguiente, cada vez, Prometeo se recuperaba del hígado, pero por la noche el águila volvía a masacre en el vientre. Así para siempre. Muchas veces se ha dicho que el hígado de Prometeo representa a la vez la fortaleza y la debilidad del ser humano, destruido cada noche y creado cada mañana.
Este pasaje demuestra que desde la antigüedad se conoce el carácter especial y la importancia del hígado. Y es que el hígado es uno de los órganos más importantes del ser humano y, en general, de los animales vertebrados. Así, el cáncer provoca un montón de muertes al atacar el hígado, el segundo de los más letales [1]. Además, entre un 60% y un 80% de los pacientes con cáncer de colon, páncreas o mama padecen metástasis hepáticas, es decir, los tumores generados fuera del hígado se extienden al hígado [2]. Es evidente, por tanto, que las investigaciones sobre el cáncer de hígado son muy importantes. Gracias a ellos han llegado tratamientos como la denominada radioembolización. En los últimos años esta última se está imponiendo.
En las siguientes líneas se explicarán las aportaciones de interés que pueden hacer los ingenieros industriales a la radioembolización y a la medicina en general. Para afrontar nuevos retos cada vez más complejos es necesario que profesionales de diferentes ámbitos trabajen en la misma dirección, en colaboración. El autor ha colaborado con los médicos de la Clínica Universidad de Navarra. En concreto, durante su tesis doctoral ha analizado la radioembolización y diversas variables que pueden influir en el tratamiento.
Radioembolización
La embolización consiste en obstruir (cerrar) los vasos sanguíneos, en definitiva impedir el transporte de la sangre. La irradiación es el uso terapéutico de la energía radiactiva.
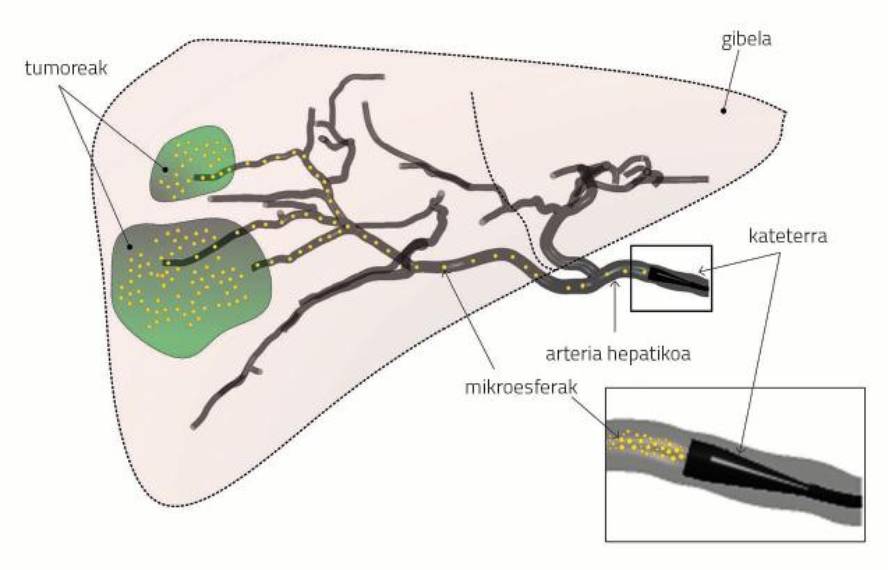
Durante la radioembolización, el médico realiza una incisión en la arteria femoral (zona inguinal), donde introduce un catéter de diámetro aproximado 1 mm. Después lo lleva manualmente hasta la arteria hepática (arteria hepática). Una vez situado el extremo del catéter en la arteria hepática inyecta microesferas radiactivas de 32 ?m de diámetro (y presentes en el agua). El flujo sanguíneo transporta las microesferas. El objetivo es transferir las partículas radiactivas a los tumores y minimizar la irradiación de las partes sanas del hígado (ver figura 1).
Las microesferas llevan adherido un radioisótopo itrio-90 (emite irradiación beta en torno a 2,5 mm de retorno, con una vida media de 2,6 días). El tratamiento dura aproximadamente una hora y normalmente el paciente vuelve a casa el mismo día.
Sin embargo, antes de jeringar las microesferas que constituyen una fuente de radiación en el cuerpo, es necesario un tratamiento previo que asegure la llegada de las partículas al lugar adecuado. El pretratamiento se realiza con partículas inocuas. Así, mediante imágenes médicas se analiza el destino de las microesferas. Este estudio sirve para determinar la posición del catéter en el tratamiento (sensu estricto) y la velocidad con la que se inyectan las microesferas.
El tratamiento es seguro y efectivo. Sin embargo, hay que tener en cuenta que el médico coloca el catéter de forma manual y recita microesferas a mano. Por lo tanto, si la localización del catéter y la velocidad de inyección de partículas no son exactas, y por tanto se irradian zonas que no deben ser tratadas, pueden surgir problemas como hepatitis, neumonía y úlceras estomacales e intestinales.
Ingenieros sumando el ejército de la radioembolización
La radioembolización es un tratamiento realmente complejo, ya que requiere la colaboración de los intervencionistas de radiología, oncólogos de radiación, médicos nucleares, etc. (físicos médicos, hepatólogos, etc.). En la citada tesis, los ingenieros se unieron a este gran grupo con el objetivo de analizar la dinámica del flujo sanguíneo en la arteria hepática y el comportamiento de sus partículas.
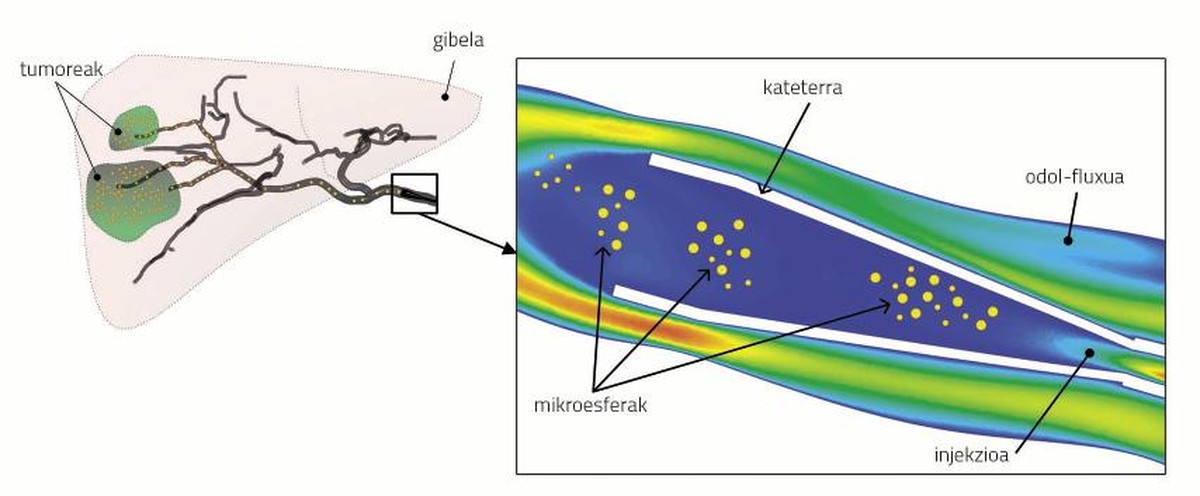
Durante el estudio se ha utilizado la herramienta Computational Fluid Dynamics (CFD) para simular el flujo sanguíneo y el transporte de microesferas. El CFD considera la geometría, las ecuaciones del fenómeno físico y las condiciones límite. La geometría consiste en definir en qué zonas se estudiará el flujo sanguíneo y el transporte de microesferas. Por el contrario, las ecuaciones del fenómeno físico definen el flujo sanguíneo y el transporte de las microesferas. Por último, el establecimiento de las condiciones límite implica la colocación de determinadas características en los límites de la zona objeto de estudio, tanto en lo que se refiere al flujo sanguíneo (presión y velocidad) como a las microesferas (velocidad).
Una adecuada definición de los tres componentes permite elaborar un modelo fiable. Y, por supuesto, las simulaciones realizadas con un modelo fiable representan la presión y velocidad de la sangre y la velocidad de las partículas. En la figura 2 se puede observar, por ejemplo, la velocidad del flujo sanguíneo alrededor del catéter y la localización de las microesferas.
Pero hay que tener claro que en el análisis sólo se puede analizar lo que ocurre en la primera parte del transporte. De momento, no es posible ver cómo viajan las microesferas a través de pequeñas arterias, ni el efecto de la irradiación en el tumor. Por ello, en la investigación, diremos que la radioembolización es un éxito si las microesferas salen de las salidas esperadas, es decir, de los conductos que suministran sangre a los tumores (Figura 1).
Parámetros analizados
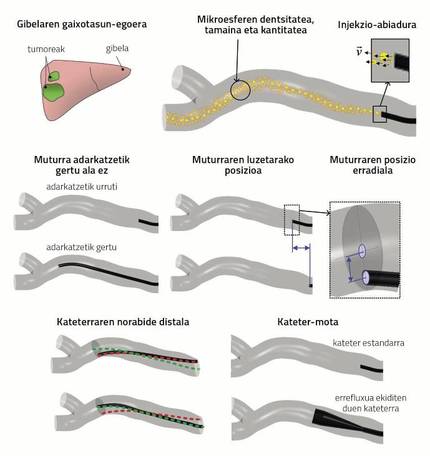
La investigación basada en simulaciones CFD se ha realizado con el objetivo de dar respuesta a las fuentes de discusión encontradas en la literatura y a las inquietudes de los médicos de la Clínica Universidad de Navarra. Para ello se seleccionaron una serie de parámetros que parecían influir en el resultado de la radioembolización. La figura 3 puede ayudar a comprender los parámetros que se enumeran a continuación, ya que resume gráficamente las variables.
? Estado de enfermedad del hígado: relacionado con el tamaño, localización y tipo de los tumores. Afecta a la demanda sanguínea del hígado y, por tanto, a la capacidad de tomar microesferas.
? Densidad, tamaño y cantidad de las microsferas: las microesferas utilizadas en pretratamiento y tratamiento son diferentes.
? Velocidad de inyección de microsferas: es difícil reproducir en tratamiento este parámetro especificado en el pretratamiento, ya que, como ya se ha indicado, el médico inyecta las partículas manualmente.
? Proximidad de la punta del catéter a la bifurcación del vaso sanguíneo.
? Posición longitudinal del extremo: aquí también es difícil repetir en tratamiento lo especificado en el pretratamiento.
? Posición radial del extremo: otro tanto.
? Dirección distal del catéter: lo mismo.
? Tipo de catéter: en la actualidad existen numerosas investigaciones sobre el diseño en marcha. En la investigación a la que se refiere este artículo se ha estudiado el catéter estándar y el catéter que evita el reflujo (véase el “Tipo de catéter” de la figura 3).
No hay que olvidar que la modificación de algún parámetro modifica la distribución de las microesferas y su destino. Además, la colocación de un catéter en la arteria supone la modificación de las características hemodinámicas (presión y velocidad) del flujo sanguíneo, que al ser una barrera física condiciona el flujo natural. Como consecuencia, la trayectoria y distribución de las microsferas varía. Por ello, es muy importante conocer de antemano las características del flujo sanguíneo cercano al extremo del catéter.
Si bien en la tesis se ha analizado la influencia de cada uno de los ocho parámetros de la lista, aquí se explicará la situación del catéter, probablemente la variable más importante.
Importancia de la ubicación del catéter
Al hacer el corte e introducir el catéter hay dos opciones principales: que el extremo del catéter quede cerca de alguna de las ramificaciones de la arteria o que quede alejado (ver “extremo próximo o no a la ramificación” de la figura 3). El resto de parámetros relacionados con la ubicación del catéter son la posición longitudinal del extremo, la posición radial del extremo, la dirección distal del catéter y el tipo de catéter (ver figura 3).
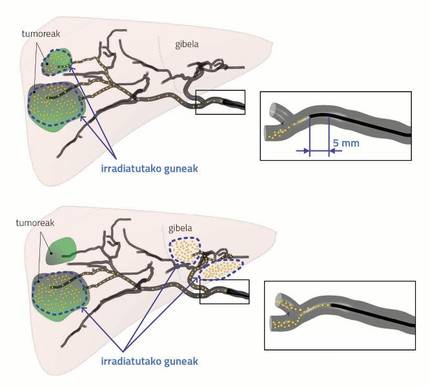
Si la inyección se realiza lejos de la bifurcación, la distribución de las microesferas adopta la forma de flujo sanguíneo, alineándolas con el flujo sanguíneo. En este caso, los cambios en el resto de parámetros no afectan a la distribución de las microsferas. Sin embargo, si las partículas se xiringen cerca de la bifurcación, los cambios en los parámetros condicionan la distribución de las microesferas.
La figura 4 muestra claramente que una diferencia de poco más de 5 mm (longitud de una hormiga) tiene una gran influencia en la distribución de las partículas. La xiringación cercana (caso superior) es el resultado de una exitosa radioembolización que consiste en transferir las microesferas a ambos tumores (irradiación de ambos tumores). Lejos, sin embargo, no. En el segundo caso, uno de los tumores no ha sido irradiado y, además, el hígado sano ha sido bombardeado.
Reflexiones finales
Lo que está claro desde la época de Prometeo o desde antes es que la salud es la principal responsabilidad humana.
Además, los ingenieros Sznitman y Steinman han previsto que las investigaciones con el CFD serán importantes en los próximos años [3]. Servirán para crear nuevos tratamientos o mejorar los existentes, ¡cuidado con los enfermos de cáncer!
Hay mucho que hacer, pero conviene ir paso a paso, “rápido y bien, las palomas volando”.
Referencias
Trabajo presentado a los premios CAF-Elhuyar.