Enfermidade cardiovascular: fisiopatología e novos tratamentos
Doktoregaia
Biokimika eta Biologia Molekularra Saila (EHU) eta Biofisika Institutua (EHU-CSIC)
Ikertzailea
Biokimika eta Biologia Molekularra Saila (EHU) eta Biofisika Institutua (EHU-CSIC)
Irakaslea eta ikertzailea
Biokimika eta Biologia Molekularra Saila (EHU) eta Biofisika Institutua (EHU-CSIC)
As enfermidades cardiovasculares son un conxunto de trastornos cardiovasculares que teñen como causa principal una patoloxía denominada aterosclerosis que se desenvolve por acumulación de colesterol nas arterias. Nesta revisión descríbese a fisiopatología da aterosclerosis e os novos tratamentos propostos.
As enfermidades cardiovasculares (GKBs) son o conxunto de enfermidades que máis mortes xeran. Cada ano morren 17,9 millóns de persoas, principalmente por infartos e infartos1. Ademais, a diferenza do que habitualmente se cre, a incidencia de GKB non é só una característica propia dos países de renda alta.
Entre os factores de risco atópanse factores xenéticos ou dependentes da idade como a hipertensión, altos niveis de colesterol e glicosa en sangue e o sobrepeso. Doutra banda, os hábitos de comportamento que están nas nosas mans: una dieta insana, un consumo nocivo de tabaco e alcol e unhas actividades físicas inadecuadas. De feito, a maioría dos infartos e do corazón pódense evitar mellorando os hábitos de vida e, por suposto, recibindo un tratamento adecuado cando sexa necesario.
Por último, a situación económica persoal e o grao de desenvolvemento do país de residencia teñen moito que ver tanto na detección como no tratamento de enfermidades. Por iso, actualmente, máis de tres de cada catro pacientes con GKB son diagnosticados en países subdesarrollados, segundo a Organización Mundial da Salud1.
Como se producen os infartos?
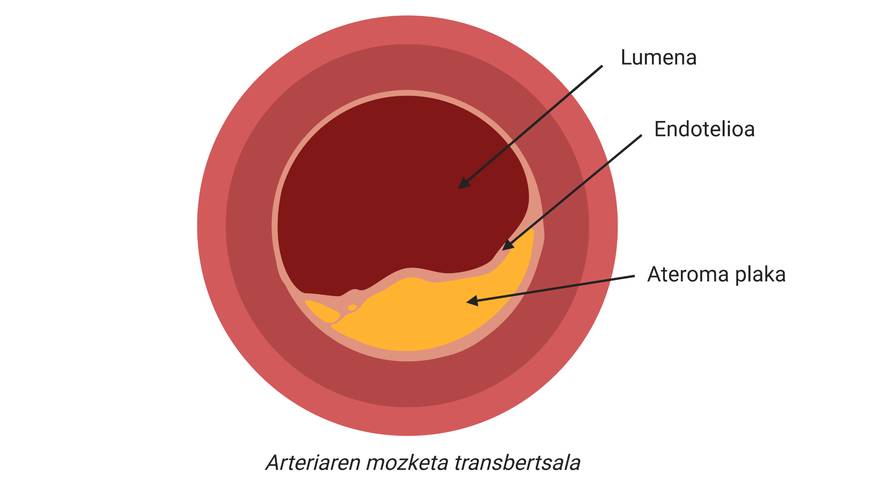
Os infartos e os infartos son complicacións clínicas da aterosclerosis, una das principais causas de enfermidades cardiovasculares, caracterizada pola acumulación de colesterol e elementos fibrosos nas arterias principais.
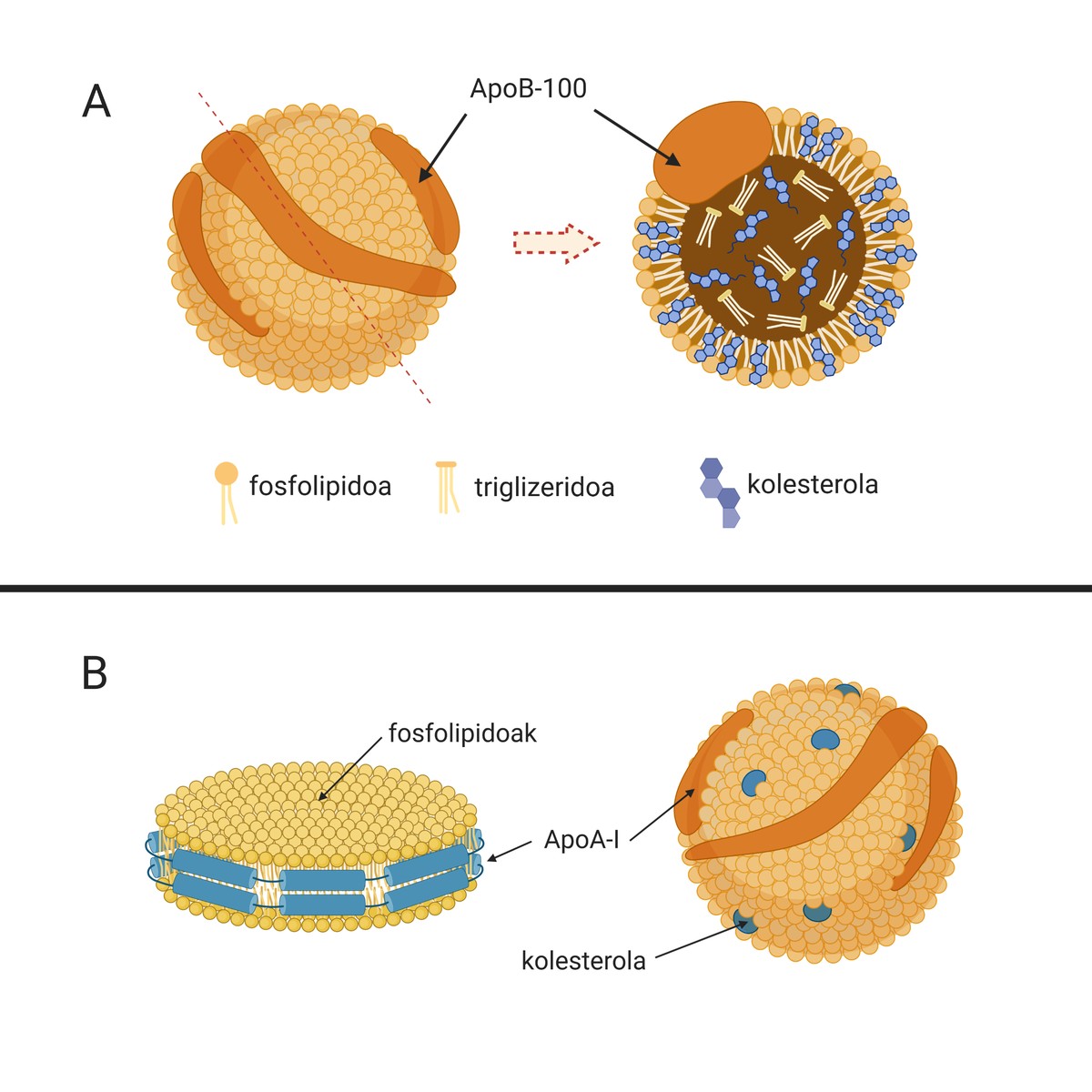
As causas desta enfermidade son as lipoproteínas de baixa densidade ou partículas naturais chamadas LDL (do inglés Low Density Lipoprotein), coñecidas como “colesterol malo”. Estas partículas (A.1. A imaxe está composta por lípidos e apolipoproteínas que se encargan do transporte do colesterol desde o fígado (órgano encargado da síntese da maior parte do colesterol endóxeno) a outros tecidos paira a súa subministración. De feito, o colesterol é una molécula imprescindible paira moitos procesos celulares. Pero se isto é así, por que ten o sobrenome de “colesterol malo”?
As partículas LDL son capaces de atravesar o endotelio das arterias corporais e de almacenalo baixo el, o que pode ser prexudicial, sobre todo en persoas cun alto grao de LDL en sangue (por exemplo, en pacientes con hipercolesterolemia).
De feito, una vez que as LDL atópanse dentro da arteria, comezan a oxidarse converténdose en LDL oxidado (LDL ox), xa que non hai antioxidantes presentes no sangue (Figura 2). En consecuencia, os macrófagos, as células encargadas da limpeza do noso corpo, interiorizarán as partículas LDL por medio de receptores, xa que detectan que son nocivas paira o organismo, é dicir, encargaranse da súa eliminación. Se a acumulación de LDL é demasiado elevada, os macrófagos seguirán interiorizándose incontroladamente a través de mecanismos non regulatorios e as pingas de colesterol iranse acumulando no seu interior. Ante unha situación incontrolable, atraerán a outro tipo de células e poranse en marcha mecanismos inflamatorios nos que se empezará a desenvolver a aterosclerosis (Figura 2).
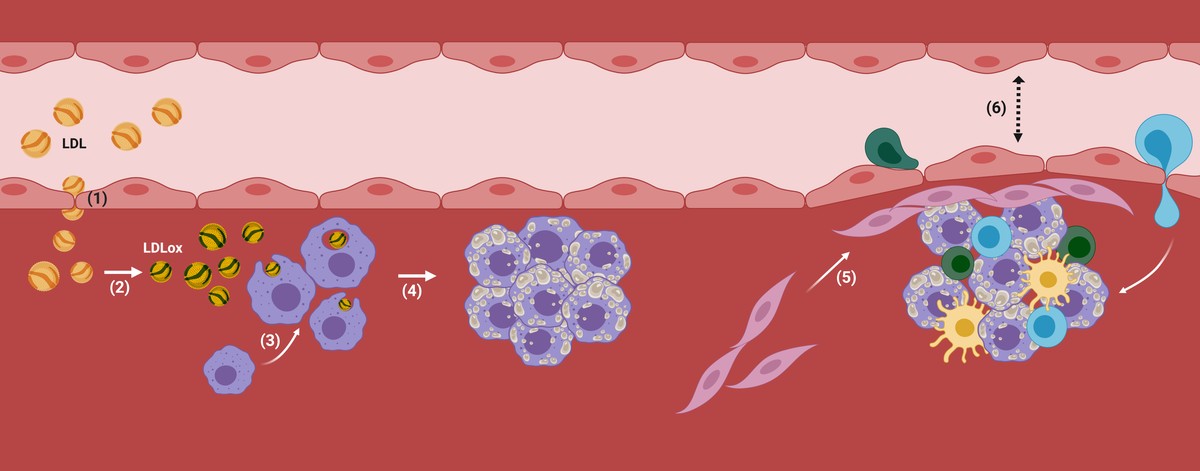
Deste xeito, acumularanse máis colesterol e certos tipos de células na zona subdotelial da arteria. Ademais, comezarase a recubrir a placa cun material ríxido producido polas células paira evitar que a lesión producida vértase á corrente sanguínea. Co paso do tempo, esta zona da arteria será cada vez máis ancha e por tanto, o diámetro do vaso sanguíneo será máis estreito. Aí está a placa aterosclerótica (figura 2).
Hai que dicir que en situacións fisiológicas pódese evitar o desenvolvemento desta placa, xa que o noso organismo dispón de mecanismos paira evitar o seu desenvolvemento. Entre elas atópanse lipoproteínas de alta densidade ou partículas lipídicas chamadas HDL (do inglés High Density Lipoprotein) (1.B.). Imaxe). Tamén son partículas naturais que se encargan do transporte do colesterol, pero neste caso levan a cabo un proceso contra as LDL: recollen o colesterol sobrante dos tecidos periféricos e lévano ao fígado paira o seu excreción. Este proceso denomínase transporte inverso ao colesterol. Con todo, posteriormente profundaremos na importancia dos HDL na aterosclerosis.
A verdadeira complicación clínica pode producirse cando una parte da placa ateroma é desestabilizada e liberada, xa que se forma un trombo ou coágulo. Isto débese a que o trombo pode bloquear un vaso sanguíneo, polo que o tecido que rodea o vaso empezará a morrer por falta de osíxeno. Así, chamamos infarto á morte deste tecido e, se ocorre no corazón, ao infarto.
Aínda non existe ningún fármaco que trate directamente a aterosclerosis, é dicir, que implique a redución da placa de ateroma. Por iso, o tratamento da enfermidade baséase na redución dos niveis de LDL en sangue, utilizando paira iso estátinas tan coñecidas, co fin de previr máis que o tratamento da aterosclerosis.
Doutra banda, ás persoas diagnosticadas de aterosclerosis realízaselles un seguimento da placa e cando poden supor un risco paira o paciente adóitanse retirar con métodos invasivos. Uno destes métodos invasivos é a endarterectomía, que consiste na extirpación da placa de ateroma a través de una intervención cirúrxica.
Pero existe a posibilidade de eliminar a placa de ateroma?
Desde hai varios anos está a investigarse en fármacos que teñen como obxectivo frear o desenvolvemento da aterosclerosis e eliminar a placa ateroma, até os que se levaron a ensaios clínicos tan diversos como os procesos que interveñen no desenvolvemento da aterosclerosión3. Con todo, o seu grao de éxito demostra que aínda non se atopou a clave paira tratar a aterosclerosis.
Entre outros, propuxéronse en varias ocasiones fármacos que evitan a oxidación das LDL, pero, aínda que funcionen en laboratorio, nunca se obtiveron resultados significativos en pacientes. As vitaminas de función antioxidante (vitaminas C, D e E) tamén foron testadas en grandes ensaios clínicos, sen mellores resultados.
Doutra banda, realizáronse ensaios que reducen a inflamación. Por exemplo, o ensaio clínico denominado CANTOS, finalizado en 2017, demostrou a súa eficacia en pacientes con síndrome coronaria agudo. Neste ensaio utilizouse un anticorpo chamado canakinumab, que reduce a inflamación e con el os episodios cardiovasculares. Con todo, a incidencia de infeccións mortais foi maior no grupo tratado con canaquinumab en comparación co grupo de placebos, e houbo que descartar o tratamento.
Ultimamente propúxose tamén inmunoterapia, como a utilización de moléculas naturais que estimulan a protección do sistema inmunitario. Por exemplo, no ensaio clínico LILAC actualmente en marcha propúxose a administración de baixas doses de interleucina IL-2 co fin de inducir a estabilidade da placa ateroma.
HDL como novo tratamento da aterosclerosis
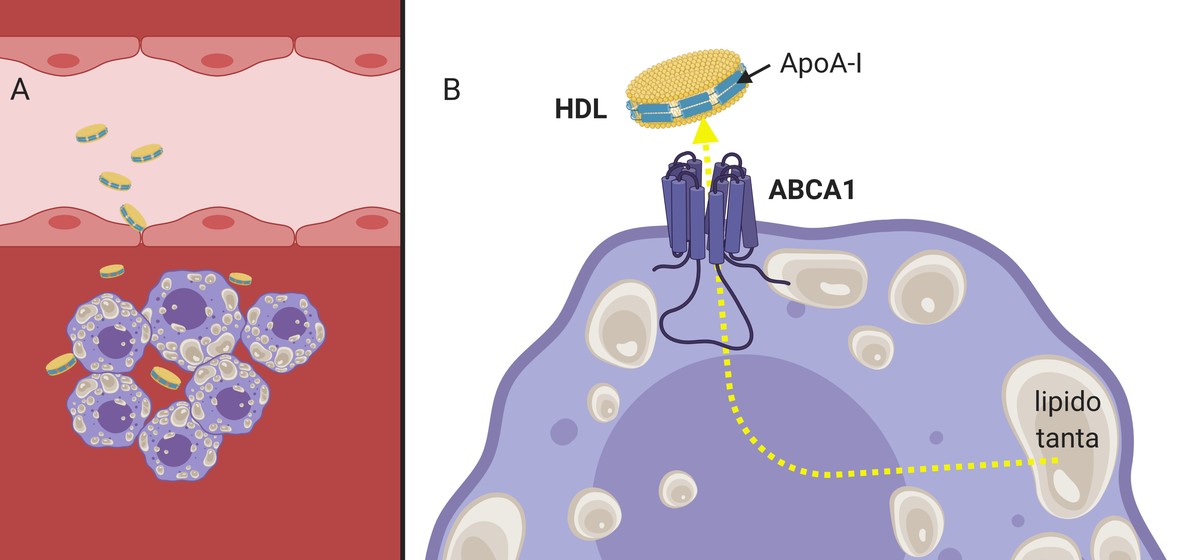
Como xa se mencionou anteriormente, paira facer fronte ao desenvolvemento da placa de ateroma, existen unhas partículas naturais chamadas HDL, responsables do transporte inverso do colesterol. De feito, os HDL recollen do tecido corporal (e tamén da placa) o colesterol sobrante e transpórtano ao fígado para que sexa eliminado xunto coa bilis. Por iso é polo que as HDL denomínense “colesterol bo”.
Do mesmo xeito que as LDL, as HDL son capaces de atravesar a parede arterial (xa que son moito máis pequenas en tamaño) e cumprir a súa función (3.A. Imaxe), recollen o colesterol dos macrófagos que empezan a acumularse dentro da arteria. Paira iso, a apolipoproteína apoA-I presente nos HDL interacciona cos receptores da membrana celular dos macrofagos, que, funcionando como canle, pasarán ao HDL un colesterol sobrante (3.B. Imaxe). Posteriormente, cheas de colesterol, as partículas HDL volverán á corrente sanguínea até o fígado.
Demostrouse que, ademais de inducir o eflujo ou fluxo cara ao exterior do colesterol, os HDL son capaces de reducir os sinais inflamatorias na placa ateroma3. Por todas estas características considérase que as partículas HDL son protectoras de saco. Non é estraño, por tanto, que moitos grupos de investigación sinteticen no laboratorio HDL co obxectivo de inducir a eliminación do colesterol.
As primeiras partículas in vitro HDL formáronse nos anos 70 e 80; as rHDL a partir de agora (reconsituted HDL). Paira a súa síntese empregáronse a principal proteína de HDL, apoA-I e varias mesturas de lípidos4. Desta forma, obtivéronse partículas discoidales a nanoescala que tiñan a mesma aparencia que os HDL naturais. Desde entón publicáronse numerosas combinacións de RHDL e mediuse a súa funcionalidade mediante a capacidade de tomar colesterol das células da placa de ateroma. Tiveron un éxito excelente 5,6.
Dos estudos in vitro, pasouse aos estudos in vivo mediante ensaios clínicos, os primeiros rHDL que foron probados en humanos, os ensaios clínicos denominados MILANO-PILOT, que finalizaron en 2016. Durante este ensaio, unha vez á semana forneceuse aos pacientes una determinada cantidade destas nanopartículas mediante inxección intravenosa. Con todo, non obtiveron resultados significativos na redución da placa de ateroma e tiveron que suspender o ensaio clínico.
Posteriormente realizáronse outros intentos, e nun ensaio clínico en marcha actualmente estase probando una nova composición lipídica de rHDL, coa que se espera que aumente a eficiencia. Paira coñecer os seus resultados hai que esperar ao ano que vén.
Cabe destacar que se están realizando interesantes ensaios paira a utilización de partículas rHDL no tratamento do cancer. Nestes casos, con todo, os rHDL utilízanse como sistema de transporte de fármacos contra o cancro, xa que o composto activo inclúese dentro da nanopartícula. Con esta formulación espérase minimizar os efectos secundarios tan graves en quimioterapia, xa que demostraron que os RHDL teñen especificidad tumoral. É dicir, mediante o transporte do fármaco na nanopartícula reduciríase a liberación de plasma e, por tanto, reduciríanse os efectos adversos sobre outros tecidos. Ademais, ao tratarse dun tratamento corrixido, pódense utilizar doses inferiores ás normais, obtendo o mesmo efecto contra o cancro.
Con todo, nas enfermidades cardiovasculares, o uso de rHDL aínda non se estendeu a ensaios clínicos. Existen estudos in vitro nos que se proban formulaciones rHDL que transportan estatinas, pero de momento non se propuxo ningunha proba clínica. E vendo que até agora os ensaios paira inducir o eflujo do colesterol non conseguiron resultados esperanzados12–14, sería interesante levar a cabo esta proposta.
BIBLIOGRAFÍA
1.World Health Organization. https://www.who.int/health-topics/cardiovascular-diseases
2.Linton, M. F. et ao. The Role of Lipids and Lipoproteins in Atherosclerosis. Endotext (eds. Feingold, K. R. et ao.) (MDT ext.com, Inc., 2000), South Dartmouth (MA).
3.Navab, M., Reddy, S. T., Van Lenten, B. J. e Fogelman, A. M. 2011. HDL and cardiovascular disease: atherogenic and atheroprotective mechanisms. Nat. Rev. Cardiol. 8, 222–232.
4ºMatz, C. E. e Jonas, A. 1982. "Micellar complexes of human apolipoprotein A-I with phosphatidylcholines and cholesterprepared from cholate-lipid dispersions". J. Biol. Chem. 257, 4535–4540.
5.Tang, J. et ao. 2016 "Inmune cell screening of a nanoparticle library improves atherosclerosis therapy". Proc. Natl. Acad. Sci. 113, E6731–E6740.
6ºCukier, A. M. Ou. et ao. 2017 "Structure-function relationships in reconstituted HDL: Focus on antioxidative activity and cholesterefflux capacity". Biochim. Biophys. Acta Mol Cell Biol. Lipids 1862, 890–900.
7.Gibson, C. M. et ao. 2019. "The CSL112-2001 trial: Safety and tolerability of multiple doses of CSL112 (apolipoprotein A-I [human]), an intravenous formulation of plasma-derived apolipoprotein A-I, among subjects with moderate renal imáns after acute myocardial infarction". Am. J. Heart 208, 81–90.
8º. Sabnis, N., Pratap, S., Akopova, I., Bowman, P. W. e Lacko, A. G. 2013 Pre-Clinical Evaluation of rHDL Encapsulated Retinoids for the Treatment of Neuroblastoma. Front. Pediatría. 1º, 6º
9.Morin, E. R. Li, X. e Schwendeman, A. 2018. "HDL in Endocrine Carcinomas: Biomarker, Drug Carrier, and Potential Therapeutic". Front. Endocrinol. 9, 715.
10. Raut, S. et ao. 2018. "Reconstituted HDL: Drug Delivery Platform for Overcoming Biological Barriers to Cancer Therapy". Front. Pharmacol. 9, 1154.
11.Duivenvoorden, R. et ao. 2014 "A statin-loaded reconstituted high-density lipoprotein nanoparticle inhibits atherosclerotic plaque inflammation". Nat. Comun. 5, 3065.
12. Nicholls, S. J. et ao. 2018. "Effect of Infusion of High-Density Lipoprotein Mimetic Containing Recombinant Apolipoprotein A-I Milano on Coronary Disease in Patients With an Acute Coronary Syndrome in the MILANO-PILOT Trial: A Randomized Clinical Trial". JAMA Cardiol. 3, 806-814.
13. Nicholls, S. J. et ao. 2018. "Effect of Serial Infusions of CER-001, a Pre-b High-Density Lipoprotein Mimetic, on Coronary Atherosclerosis in Patients Following Acute Coronary Syndromes in the CER-001 Atherosclerosis Neacute Regression Tracense: A Randomized Clinical Trial". JAMA Cardiol. 3, 815.
14.Tardif, J.-C. et ao. 2007 "Effects of Reconstituted High-Density Lipoprotein Infusions on Coronary Atherosclerosis". JAMA Cardiol. 297, 1675.