Malaltia cardiovascular: fisiopatologia i nous tractaments
Doktoregaia
Biokimika eta Biologia Molekularra Saila (EHU) eta Biofisika Institutua (EHU-CSIC)
Ikertzailea
Biokimika eta Biologia Molekularra Saila (EHU) eta Biofisika Institutua (EHU-CSIC)
Irakaslea eta ikertzailea
Biokimika eta Biologia Molekularra Saila (EHU) eta Biofisika Institutua (EHU-CSIC)
Les malalties cardiovasculars són un conjunt de trastorns cardiovasculars que tenen com a causa principal una patologia denominada aterosclerosi que es desenvolupa per acumulació de colesterol en les artèries. En aquesta revisió es descriu la fisiopatologia de l'aterosclerosi i els nous tractaments proposats.
Les malalties cardiovasculars (GKBs) són el conjunt de malalties que més morts generen. Cada any moren 17,9 milions de persones, principalment per infarts i infartos1. A més, a diferència del que habitualment es creï, la incidència de GKB no és només una característica pròpia dels països de renda alta.
Entre els factors de risc es troben factors genètics o dependents de l'edat com la hipertensió, alts nivells de colesterol i glucosa en sang i el sobrepès. D'altra banda, els hàbits de comportament que són a les nostres mans: una dieta insana, un consum nociu de tabac i alcohol i unes activitats físiques inadequades. De fet, la majoria dels infarts i del cor es poden evitar millorant els hàbits de vida i, per descomptat, rebent un tractament adequat quan sigui necessari.
Finalment, la situació econòmica personal i el grau de desenvolupament del país de residència tenen molt a veure tant en la detecció com en el tractament de malalties. Per això, actualment, més de tres de cada quatre pacients amb GKB són diagnosticats en països subdesenvolupats, segons l'Organització Mundial de la Salud1.
Com es produeixen els infarts?
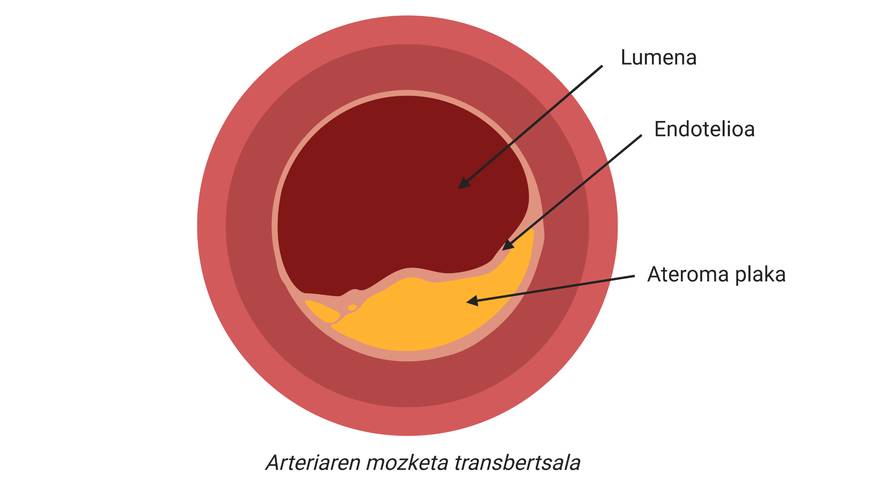
Els infarts i els infarts són complicacions clíniques de l'aterosclerosi, una de les principals causes de malalties cardiovasculars, caracteritzada per l'acumulació de colesterol i elements fibrosos en les artèries principals.
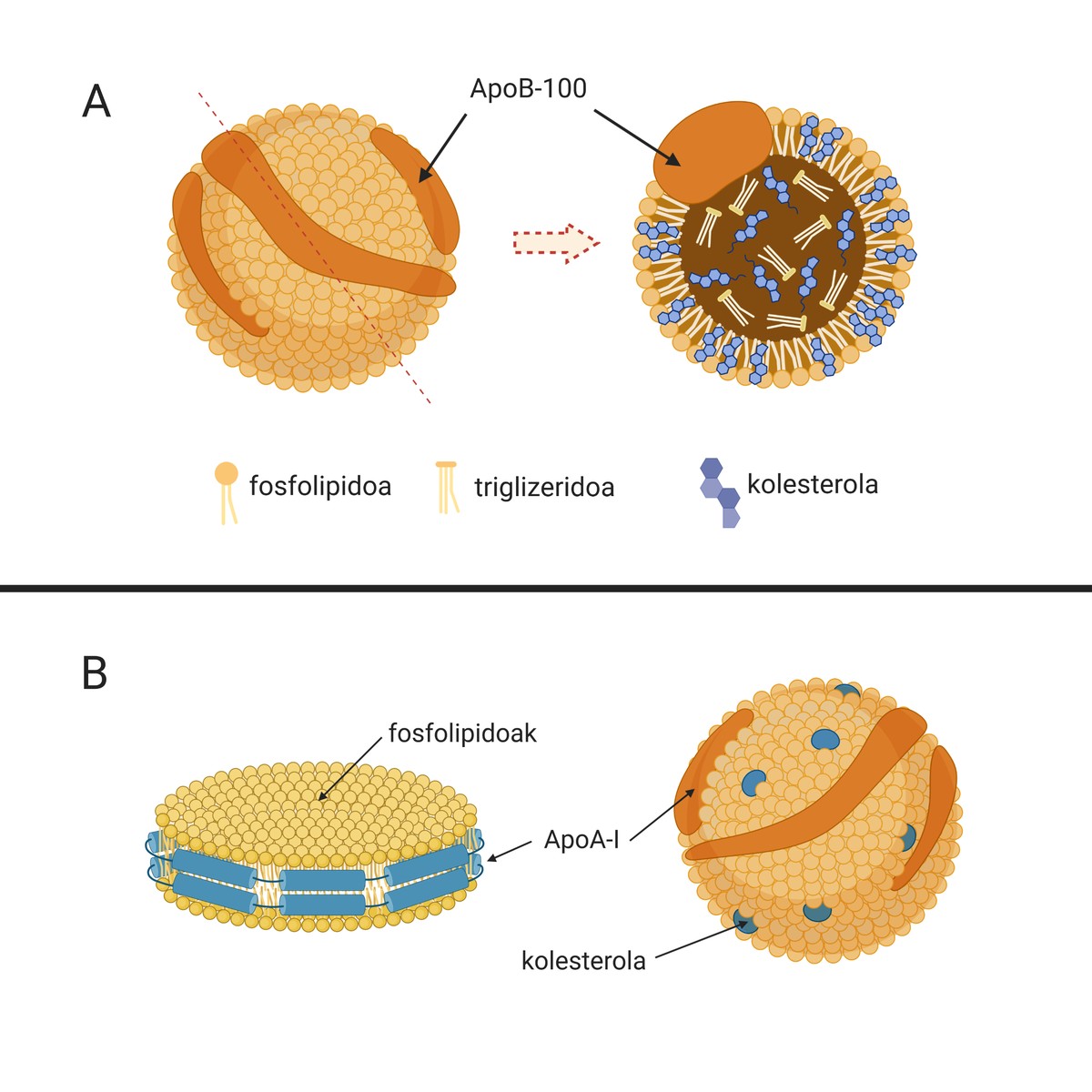
Les causes d'aquesta malaltia són les lipoproteïnes de baixa densitat o partícules naturals anomenades LDL (de l'anglès Low Density Lipoprotein), conegudes com a “colesterol dolent”. Aquestes partícules (A.1. La imatge està composta per lípids i apolipoproteïnes que s'encarreguen del transport del colesterol des del fetge (òrgan encarregat de la síntesi de la major part del colesterol endogen) a altres teixits per al seu subministrament. De fet, el colesterol és una molècula imprescindible per a molts processos cel·lulars. Però si això és així, per què té el sobrenom de “colesterol dolent”?
Les partícules LDL són capaces de travessar l'endoteli de les artèries corporals i d'emmagatzemar-lo sota ell, la qual cosa pot ser perjudicial, sobretot en persones amb un alt grau de LDL en sang (per exemple, en pacients amb hipercolesterolemia).
De fet, una vegada que les LDL es troben dins de l'artèria, comencen a oxidar-se convertint-se en LDL oxidat (LDL ox), ja que no hi ha antioxidants presents en la sang (Figura 2). En conseqüència, els macròfags, les cèl·lules encarregades de la neteja del nostre cos, interioritzaran les partícules LDL per mitjà de receptors, ja que detecten que són nocives per a l'organisme, és a dir, s'encarregaran de la seva eliminació. Si l'acumulació de LDL és massa elevada, els macròfags continuaran interioritzant-se incontroladament a través de mecanismes no reguladors i les gotes de colesterol s'aniran acumulant en el seu interior. Davant una situació incontrolable, atrauran a una altra mena de cèl·lules i es posaran en marxa mecanismes inflamatoris en els quals es començarà a desenvolupar l'aterosclerosi (Figura 2).
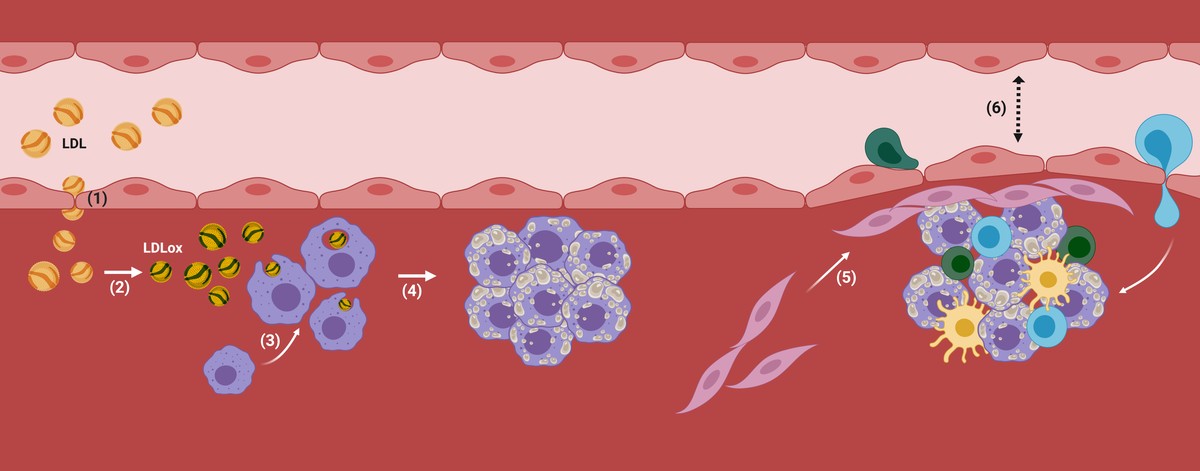
D'aquesta manera, s'acumularan més colesterol i certs tipus de cèl·lules en la zona subdotelial de l'artèria. A més, es començarà a recobrir la placa amb un material rígid produït per les cèl·lules per a evitar que la lesió produïda s'aboqui al corrent sanguini. Amb el pas del temps, aquesta zona de l'artèria serà cada vegada més ampla i per tant, el diàmetre del vas sanguini serà més estret. Aquí està la placa aterosclerótica (figura 2).
Cal dir que en situacions fisiològiques es pot evitar el desenvolupament d'aquesta placa, ja que el nostre organisme disposa de mecanismes per a evitar el seu desenvolupament. Entre elles es troben lipoproteïnes d'alta densitat o partícules lipídiques anomenades HDL (de l'anglès High Density Lipoprotein) (1.B.). Imatge). També són partícules naturals que s'encarreguen del transport del colesterol, però en aquest cas duen a terme un procés contra les LDL: recullen el colesterol sobrant dels teixits perifèrics i el porten al fetge per a la seva excreció. Aquest procés es denomina transport invers al colesterol. No obstant això, posteriorment aprofundirem en la importància dels HDL en l'aterosclerosi.
La veritable complicació clínica pot produir-se quan una part de la placa ateroma és desestabilitzada i alliberada, ja que es forma un trombe o coàgul. Això es deu al fet que el trombe pot bloquejar un vas sanguini, per la qual cosa el teixit que envolta el got començarà a morir per falta d'oxigen. Així, diem infart a la mort d'aquest teixit i, si ocorre en el cor, a l'infart.
Encara no existeix cap fàrmac que tracti directament l'aterosclerosi, és a dir, que impliqui la reducció de la placa d'ateroma. Per això, el tractament de la malaltia es basa en la reducció dels nivells de LDL en sang, utilitzant per a això estátinas tan conegudes, amb la finalitat de prevenir més que el tractament de l'aterosclerosi.
D'altra banda, a les persones diagnosticades d'aterosclerosis se'ls realitza un seguiment de la placa i quan poden suposar un risc per al pacient se solen retirar amb mètodes invasius. Un d'aquests mètodes invasius és l'endarterectomía, que consisteix en l'extirpació de la placa d'ateroma a través d'una intervenció quirúrgica.
Però existeix la possibilitat d'eliminar la placa d'ateroma?
Des de fa diversos anys s'està investigant en fàrmacs que tenen com a objectiu frenar el desenvolupament de l'aterosclerosi i eliminar la placa ateroma, fins els quals s'han emportat a assajos clínics tan diversos com els processos que intervenen en el desenvolupament de l'aterosclerosión3. No obstant això, el seu grau d'èxit demostra que encara no s'ha trobat la clau per a tractar l'aterosclerosi.
Entre altres, s'han proposat en diverses ocasions fàrmacs que eviten l'oxidació de les LDL, però, encara que funcionin en laboratori, mai s'han obtingut resultats significatius en pacients. Les vitamines de funció antioxidant (vitamines C, D i E) també han estat testades en grans assajos clínics, sense millors resultats.
D'altra banda, s'han realitzat assajos que redueixen la inflamació. Per exemple, l'assaig clínic denominat CANTOS, finalitzat en 2017, va demostrar la seva eficàcia en pacients amb síndrome coronària aguda. En aquest assaig es va utilitzar un anticòs anomenat canakinumab, que redueix la inflamació i amb ell els episodis cardiovasculars. No obstant això, la incidència d'infeccions mortals va ser major en el grup tractat amb canaquinumab en comparació amb el grup de placebos, i va caldre descartar el tractament.
Últimament s'ha proposat també immunoteràpia, com la utilització de molècules naturals que estimulen la protecció del sistema immunitari. Per exemple, en l'assaig clínic LILAC actualment en marxa s'ha proposat l'administració de baixes dosis d'interleucina IL-2 amb la finalitat d'induir l'estabilitat de la placa ateroma.
HDL com a nou tractament de l'aterosclerosi
Com ja s'ha esmentat anteriorment, per a fer front al desenvolupament de la placa d'ateroma, existeixen unes partícules naturals anomenades HDL, responsables del transport invers del colesterol. De fet, els HDL recullen del teixit corporal (i també de la placa) el colesterol sobrant i el transporten al fetge perquè sigui eliminat juntament amb la bilis. Per aquest motiu les HDL es denominin “colesterol bo”.
Igual que les LDL, les HDL són capaces de travessar la paret arterial (ja que són molt més petites en grandària) i complir la seva funció (3.A. Imatge), recullen el colesterol dels macròfags que comencen a acumular-se dins de l'artèria. Per a això, l'apolipoproteïna apoA-I present en els HDL interacciona amb els receptors de la membrana cel·lular dels macrofagos, que, funcionant com a canal, passaran a l'HDL un colesterol sobrant (3.B. Imatge). Posteriorment, plenes de colesterol, les partícules HDL tornaran al corrent sanguini fins al fetge.
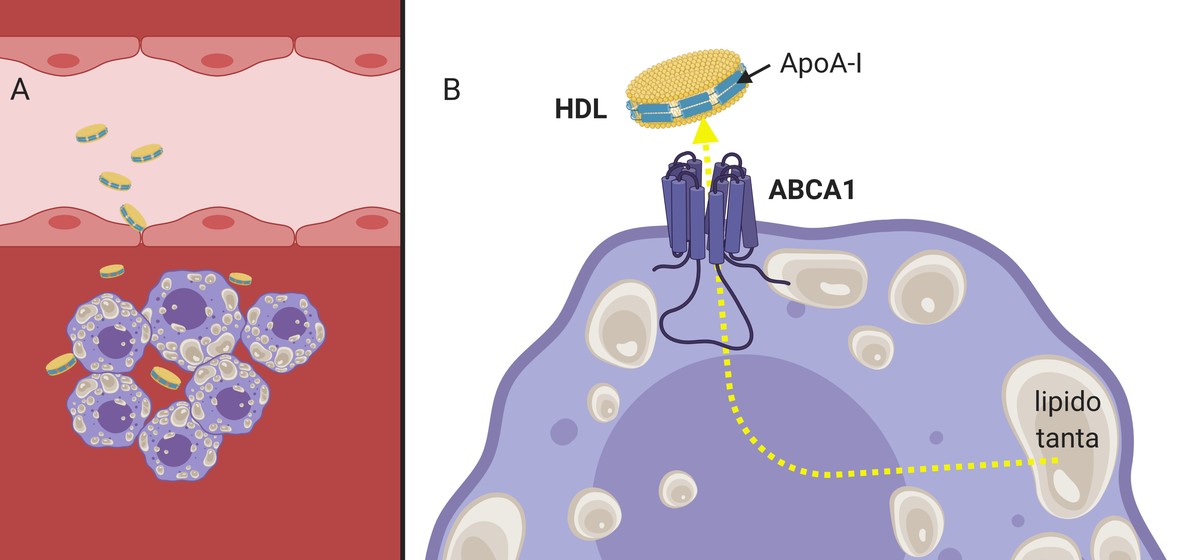
S'ha demostrat que, a més d'induir l'eflujo o flux cap a l'exterior del colesterol, els HDL són capaços de reduir els senyals inflamatoris en la placa ateroma3. Per totes aquestes característiques es considera que les partícules HDL són protectores de sac. No és estrany, per tant, que molts grups de recerca hagin sintetitzat en el laboratori HDL amb l'objectiu d'induir l'eliminació del colesterol.
Les primeres partícules in vitro HDL es van formar en els anys 70 i 80; les rHDL a partir d'ara (reconsituted HDL). Per a la seva síntesi es van emprar la principal proteïna d'HDL, apoA-I i diverses mescles de lípidos4. D'aquesta forma, es van obtenir partícules discoidals a nanoescala que tenien la mateixa aparença que els HDL naturals. Des de llavors s'han publicat nombroses combinacions de RHDL i s'ha mesurat la seva funcionalitat mitjançant la capacitat de prendre colesterol de les cèl·lules de la placa d'ateroma. Han tingut un èxit excel·lent 5,6.
Dels estudis in vitro, es va passar als estudis in vivo mitjançant assajos clínics, els primers rHDL que van ser provats en humans, els assajos clínics denominats MILÀ-PILOT, que van finalitzar en 2016. Durant aquest assaig, una vegada a la setmana es va subministrar als pacients una determinada quantitat d'aquestes nanopartícules mitjançant injecció intravenosa. No obstant això, no van obtenir resultats significatius en la reducció de la placa d'ateroma i van haver de suspendre l'assaig clínic.
Posteriorment s'han realitzat altres intents, i en un assaig clínic en marxa actualment s'està provant una nova composició lipídica de rHDL, amb la qual s'espera que augmenti l'eficiència. Per a conèixer els seus resultats cal esperar a l'any que ve.
Cal destacar que s'estan realitzant interessants assajos per a la utilització de partícules rHDL en el tractament del cancer. En aquests casos, no obstant això, els rHDL s'utilitzen com a sistema de transport de fàrmacs contra el càncer, ja que el compost actiu s'inclou dins de la nanopartícula. Amb aquesta formulació s'espera minimitzar els efectes secundaris tan greus en quimioteràpia, ja que han demostrat que els RHDL tenen especificitat tumoral. És a dir, mitjançant el transport del fàrmac en la nanopartícula es reduiria l'alliberament de plasma i, per tant, es reduirien els efectes adversos sobre altres teixits. A més, en tractar-se d'un tractament corregit, es poden utilitzar dosis inferiors a les normals, obtenint el mateix efecte contra el càncer.
No obstant això, en les malalties cardiovasculars, l'ús de rHDL encara no s'ha estès a assajos clínics. Existeixen estudis in vitro en els quals es proven formulacions rHDL que transporten estatinas, però de moment no s'ha proposat cap prova clínica. I veient que fins ara els assajos per a induir l'eflujo del colesterol no han aconseguit resultats esperanzados12–14, seria interessant dur a terme aquesta proposta.
BIBLIOGRAFIA
1.World Health Organization. https://www.who.int/health-topics/cardiovascular-diseases
2.Linton, M. F. et al. The Role of Lipids and Lipoproteins in Atherosclerosis. Endotext (eds. Feingold, K. R. et al.) (MDT ext.com, Inc., 2000), South Dartmouth (DT.).
3.Navab, M., Reddy, S. T., Van Lenten, B. J. i Fogelman, A. M. 2011. HDL and cardiovascular disease: atherogenic and atheroprotective mechanisms. Nat. Rev. Cardiol. 8, 222–232.
4ºMatz, C. E. i Jonas, A. 1982. "Micellar complexes of human apolipoprotein A-I with phosphatidylcholines and cholesterprepared from cholate-lipid dispersions". J. Biol. Chem. 257, 4535–4540.
5.Tang, J. et al. 2016 "Immune cell cribratge of a nanoparticle library improves atherosclerosis therapy". Proc. Natl. Acad. Sci. 113, E6731–E6740.
6ºCukier, A. M. O. et al. 2017 "Structure-function relationships in reconstituted HDL: Focus on antioxidative activity and cholesterefflux capacity". Biochim. Biophys. Acta Mol Cell Biol. Lipids 1862, 890–900.
7.Gibson, C. M. et al. 2019. "The CSL112-2001 trial: Safety and tolerability of multiple doses of CSL112 (apolipoprotein A-I [human]), an intravenous formulation of plasma-derived apolipoprotein A-I, among subjects with moderate renal imants after acute myocardial infarction". Am. J. Heart 208, 81–90.
8è. Sabnis, N., Pratap, S., Akopova, I., Bowman, P. W. i Lacko, A. G. 2013 Pre-Clinical Evaluation of rHDL Encapsulated Retinoids for the Treatment of Neuroblastoma. Front. Pediatria. 1r, 6è
9.Morin, E. R. Li, X. i Schwendeman, A. 2018. "HDL in Endocrine Carcinomes: Biomarker, Drug Carrier, and Potential Therapeutic". Front. Endocrinol. 9, 715.
10. Raut, S. et al. 2018. "Reconstituted HDL: Drug Delivery Platform for Overcoming Biological Barriers to Cancer Therapy". Front. Pharmacol. 9, 1154.
11.Duivenvoorden, R. et al. 2014 "A statin-loaded reconstituted high-density lipoprotein nanoparticle inhibits atherosclerotic plaque inflammation". Nat. Comun. 5, 3065.
12. Nicholls, S. J. et al. 2018. "Effect of Infusion of High-Density Lipoprotein Mimetic Containing Recombinant Apolipoprotein A-I Milà on Coronary Disease in Patients With an Acute Coronary Syndrome in the MILÀ-PILOT Trial: A Randomized Clinical Trial". JAMA Cardiol. 3, 806-814.
13. Nicholls, S. J. et al. 2018. "Effect of Serial Infusions of CER-001, a Pre-b High-Density Lipoprotein Mimetic, on Coronary Atherosclerosis in Patients Following Acute Coronary Syndromes in the CER-001 Atherosclerosis Neacute Regression Tracense: A Randomized Clinical Trial". JAMA Cardiol. 3, 815.
14.Tardif, J.-C. et al. 2007 "Effects of Reconstituted High-Density Lipoprotein Infusions on Coronary Atherosclerosis". JAMA Cardiol. 297, 1675.