Si la gestation guérit le cœur ?
Le cœur des mammifères a pour seule fonction de pomper le sang à travers l'appareil circulatoire pour faire parvenir au cœur même et au reste des organes les nutriments et l'oxygène. La tâche est unique, mais pas lente. Les situations qui se produisent tout au long de la vie animale présentent des exigences énergétiques très variées que le cœur doit satisfaire.
Pour satisfaire ces plus grandes exigences énergétiques, le cœur doit travailler plus et cela a une conséquence : plus de stress sur les murs du cœur. Si cette augmentation persiste pendant une période de temps, le cœur peut mettre en place un mécanisme pour réduire le stress ventriculaire et maintenir ou augmenter la capacité de pompage. Malheureusement le nom du mécanisme est connu: l'hypertrophie cardiaque.
Hypertrophie cardiaque
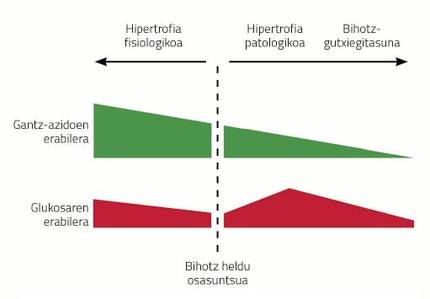
L'hypertrophie cardiaque est la conséquence de maladies telles que l'hypertension, l'infarctus produit par l'ischémie des artères coronaires ou l'obésité. Ce type d'hypertrophies sont appelés hypertrophies pathologiques et ont certaines caractéristiques. Par exemple, le métabolisme cardiaque change radicalement avec l'hypertrophie cardiaque. Contrairement au cerveau, le cœur utilise principalement des acides gras (60-70%) comme source d'énergie et le reste l'obtient du métabolisme du glucose. Lorsque le cœur est malade, l'utilisation des sources d'énergie change radicalement; le glucose devient la principale source d'énergie dans le cœur hypertrophié et les acides gras sont écartés. Si le stress chronique que le cœur hypertrophié reçoit ne disparaît pas, le cœur augmente encore, la fibrose apparaît et l'inflammation se produit en diminuant la capacité de pompage. De plus, à mesure que la maladie progresse, le cœur cesse d'utiliser du glucose, caractéristique de l'insuffisance cardiaque.
Les maladies cardiovasculaires sont les plus fréquentes dans la société actuelle et beaucoup d'entre elles ont le symptôme d'une augmentation du cœur. L'hypertrophie cardiaque se transforme souvent en une insuffisance cardiaque qui, malheureusement, n'a pas encore de remède. Par conséquent, l'insuffisance cardiaque est l'une des causes les plus courantes de mort dans les sociétés industrialisées.
De nombreuses études biomédicales en la matière sont en cours d'élaboration pour découvrir et comprendre les mécanismes moléculaires par lesquels l'hypertrophie cardiaque devient insuffisance cardiaque. Ainsi, de nouveaux épisodes thérapeutiques pourraient être développés pour éviter l'hypertrophie cardiaque ou pour que le cœur hypertrophié retourne à son état sain, tout pour éviter l'insuffisance cardiaque. Mais par où commencer, comment faire un organe hypertrophié pour revenir à sa fonction et état anatomique normal? Pour cela, nous ne devons pas chercher très loin ou en profondeur, les femelles peuvent avoir une réponse, les femelles gestionnaires.
Hypertrophie cardiaque par gestation
La gestation est un processus complexe, même biologique. La fécondation initie de nombreux changements profonds dans l'organisme d'une femelle. Tous ces changements vont permettre à l'union des deux cellules d'émerger un nouveau membre d'une espèce.
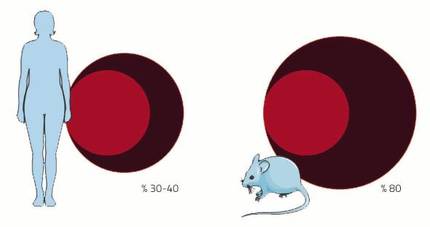
Le système cardiovasculaire est l'un des systèmes qui subira de nombreux changements pendant la gestation. La cause est le placenta. Comme si c'était peu la naissance d'un nouvel enfant, la gestation a un autre fait merveilleux : créer un nouvel organe dans un corps adulte. Ce nouvel organe a besoin, comme le reste, d'un approvisionnement en sang. Pour ce faire, le réseau sanguin et veineux se prolongera jusqu'à la date limite pour fournir du sang au placenta. En outre, le volume de sang sera augmenté pour remplir le nouvel appareil de circulation prolongée. Chez les femmes, le volume de sang augmente de 30-40%, presque le double de 80% de la souris. Et c'est que, comme dans chaque gestation les souris ont autant de plaisirs que de petits, leur demande de sang est plus grande.
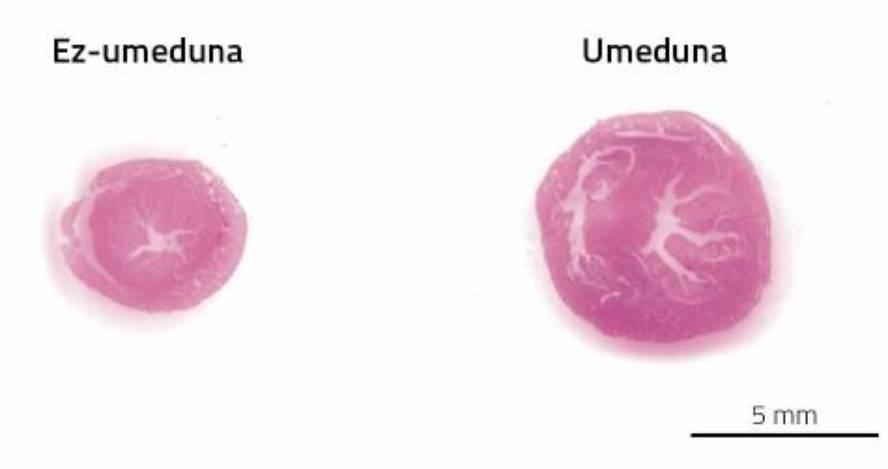
Le problème est que le cœur doit pomper plus de sang à partir d'un système de tuyauteries artérielles et veines plus long. Comme mentionné précédemment, la gestation est l'une des situations de la vie animale dans lesquelles le cœur doit travailler plus. En conséquence, les femelles gestionnaires développent une hypertrophie cardiaque. Ce type d'hypertrophie, pour sa part, est appelé bénéfique ou physiologique. Dans ce cas, le cœur n'exprime pas de fibrosité, et le métabolisme ne sélectionne pas de glucose mais au contraire, il se base plus sur des acides gras (voir figure 3).
Après l'accouchement, comme le placenta, les changements physiologiques liés à la grossesse disparaissent. Aussi hypertrophie du cœur. Dans le cas des souris, entre 7 et 14 jours après l'accouchement, le cœur est capable de récupérer sa taille d'origine; chez les femmes le processus s'allonge pendant un an.
Voilà la question. Comment exclure le cœur d'une femme gestionnaire d'hypertrophie? Pourquoi n'est-il pas possible de restaurer l'hypertrophie cardiaque qui se produit dans plusieurs maladies? Que pouvons-nous apprendre de l'hypertrophie bénéfique de la gestation pour guérir les hypertrophies pathologiques? En réponse à tout cela, les recherches effectuées dans notre laboratoire ont décrit 2 facteurs liés à l'hypertrophie gestationnelle:
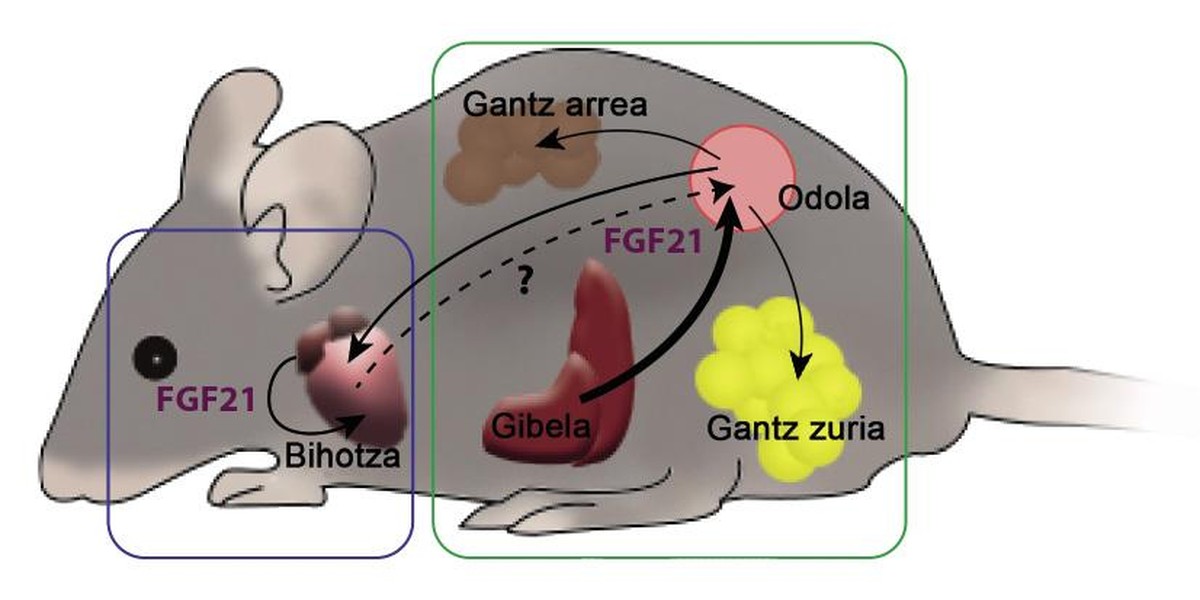
? Le premier facteur est le FGF21, facteur de croissance des fibroblastes 21. En 2000, un groupe de scientifiques japonais a découvert ce facteur comme hormone. Le facteur FGF21 est généré principalement dans le foie, puis voyage dans le sang jusqu'à ce qu'il atteigne ses tissus cibles, où il produit divers effets. L'un d'eux est le tissu adipeux brun ou gras brun. Cette hormone favorise la consommation d'acides gras. En général, le FGF21 est un facteur capable de stimuler le métabolisme, de sorte que l'hormone se soit peut-être présentée comme un fumeur de graisses. Certains laboratoires travaillent également pour les utiliser comme outil anti-diabète. Les rongeurs diabétiques traités avec FGF21 présentaient de meilleurs niveaux de glucose ou de glycémie, tout en récupérant la sensibilité à l'insuline perdue et réduisant le poids et les triglycérides dans le sang.
La relation entre FGF21 et le cœur a été inconnue il y a 5 ans. Alors nous avons édité comment le FGF21 était salutaire également pour le coeur. Les souris ont reçu une hypertrophie pathologique du cœur par un médicament. Dans ces cœurs apparaissait la fibrose, l'inflammation et l'indication restreinte des gènes qui régissent la consommation d'acides gras. Un autre groupe de souris, en plus du médicament, a inséré le FGF21, ce qui a entraîné une hypertrophie cardiaque inférieure. Le degré d'inflammation et l'expression des gènes avait également amélioré par rapport aux animaux qui n'ont reçu que le médicament. De plus, parmi les découvertes, nous démontrons que le cœur a la capacité de produire du FGF21, ce qui permettrait au cœur d'influencer le FGF21 qu'il a lui-même créé.
Pendant la gestation se produit une plus grande expression physiologique du FGF21. Le foie et aussi le cœur génèrent un facteur, de sorte que le degré de FGF21 mesurable dans le sang d'une femelle gestionnaire est beaucoup plus élevé que celui d'une femelle non-gestionnaire. En outre, en fonction de la consommation d'acides gras du cœur, pendant la gestation est beaucoup plus élevé, ce qui suppose une hypertrophie bénéfique. Dans un autre groupe d'expériences, on a travaillé avec des souris invalides pour créer le FGF21, de sorte que, bien qu'éveillé, les femelles ne pouvaient pas augmenter le niveau sanguin du facteur. Il s'ensuit que la capacité d'utiliser des acides gras était réduite. Le FGF21 est donc nécessaire pour effectuer la surcharge de travail que la gestation exige du cœur, car le cœur a besoin de FGF21 pour consommer plus d'acides gras.
? Le deuxième facteur décrit est un facteur de transcription dont la fonction est de canaliser l'expression d'autres gènes. En analysant les femelles gestionnaires, nous soulignons que la présence de ce deuxième facteur était seulement dans le cœur. Étant si spécifique cette surexpression du cœur, nous avons trouvé qu'il fallait avoir une raison derrière nous. Le facteur C/EBPb est un facteur étroitement lié à la réponse immunitaire et l'inflammation, car il est essentiel pour l'activation des macrophages. Les macrophages sont des cellules qui interviennent dans le processus inflammatoire et peuvent être de deux types: proinflammatoires (type M1), qui initieront le processus et anti-inflammatoires (type M2), qui résisteront au processus.
Comme déjà indiqué, dans le cas d'hypertrophies pathologiques, on peut observer la fibrose et l'inflammation dans les cœurs, pas dans les hypertrophies physiologiques. Dans le cas de la gestation, la présence de macrophages de type M2 était plus importante que celle de type M1. Si la moitié de la capacité à utiliser le C/NFU est retirée aux femelles porteuses, le contraire se produit dans les cœurs : Les macrophages de type M1 prédominent. Le cœur a besoin de C/EBPb pour activer les M2 macrophages et combattre l'inflammation.
Le cœur a donc des mécanismes et des voies pour rendre bénéfique une situation qui devrait être pathologique et permettre une charge de travail plus élevée que la normale, ainsi que l'élimination ultérieure de l'hypertrophie. De plus, ces mécanismes de fécondation et les autres à découvrir sont capables de protéger le cœur. Une paire d'études révèle comment les cœurs de rongeurs enfants étaient plus résistants à un médicament qui produit fibrose, et comment les dommages causés par un infarctus étaient mineurs chez les enfants.
Il convient de noter que la plupart de la recherche biomédicale réalisée avec des rats et des souris est effectuée avec des animaux mâles, soit parce qu'il a toujours été fait ainsi ou parce que les femelles doivent être gardées pour avoir des petits. Cependant, dans cet exemple, les femelles ont été la clé de la progression vers l'hypertrophie et l'insuffisance cardiaque, car elles sont les seules à avoir apporté la gestation.
Bibliographie Bibliographie
Travail présenté aux prix CAF-Elhuyar.





