Cœurs spéciaux, attention particulière
Ingeniaritza Aplikatuan doktorea eta TECNUN - Nafarroako Unibertsitateko irakasle eta ikertzailea
Notre corps est une machine très complète et efficace; le cœur, le moteur de cette machine. Parfois, cependant, le moteur vient de l'usine avec une certaine particularité, par exemple avec une maladie innée, comme c'est le cas pour 1 enfant sur 100 qui naissent [1]. Cela influence directement le fonctionnement du corps. Dans cet article, je vais vous parler de la circulation du sang des personnes nées avec un seul ventricule fonctionnel, du point de vue de la mécanique des fluides.
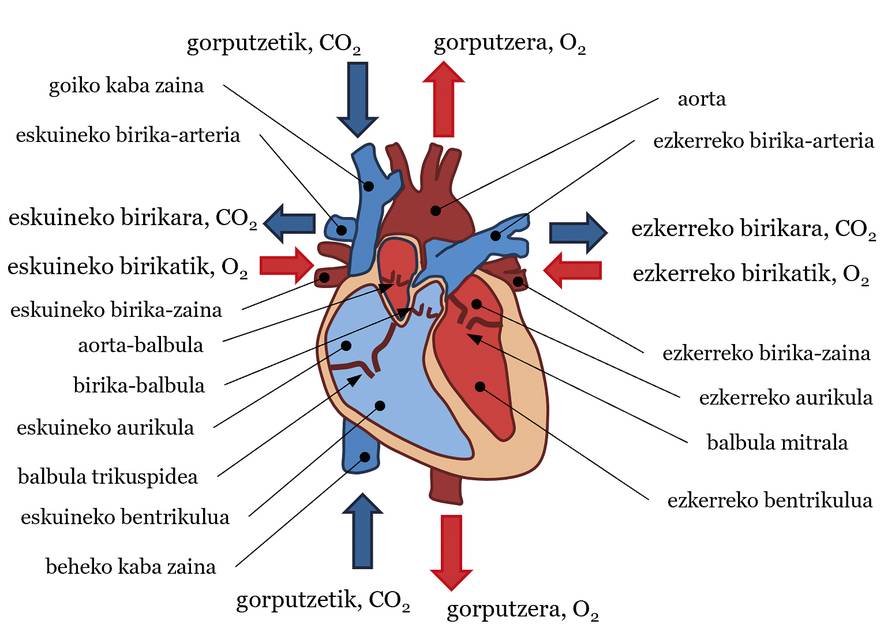
Le système cardiovasculaire est une structure très complexe composée de trois composants de base: le cœur, le sang et les vaisseaux sanguins. En général, le cœur pompe le sang et les vaisseaux sanguins transportent le sang dans toutes les parties du corps pour accomplir diverses fonctions vitales. Il s'agit notamment d'apporter de la nourriture et de l'oxygène aux tissus, de lutter contre les maladies, etc. On dit souvent que le cœur est notre moteur et, comme si une pompe à eau était traitée, il pompait le sang dans le système circulatoire. Quant à la structure, le cœur peut être divisé en deux parties, la gauche et la droite, chacune avec une oreillette et un ventricule. Entre les oreillettes et les ventricules, il y a des valves: valve mitrale dans le cœur gauche et valve trimaxi à droite. En outre, à la sortie des ventricules, on dispose d'une valve aortique dans le ventricule gauche et d'une valve pulmonaire dans le ventricule droit (voir figure 1). Le sang est aussi un liquide très spécial. 55% de son volume est fluide, le plasma — presque tout est de l'eau — et les 45% restants sont composés de particules — presque toutes sont des globules rouges. La direction du flux ou du mouvement de ce fluide, c'est-à-dire le flux sanguin, est celle qui va des zones à haute pression aux zones à faible pression. Enfin, il y a trois types de vaisseaux sanguins: artères, veines et capillaires. Les artères transportent le sang du cœur vers le corps, les veines du corps vers le cœur et les capillaires échangent des aliments et des gaz entre le sang et les tissus. En reliant cette dernière donnée à l'idée de pression, le sang a généralement plus de pression sur les artères que sur les veines.
Dans ce système, les battements cardiaques marquent le rythme du flux sanguin. Nous pouvons facilement décrire la trajectoire du flux sanguin à chaque battement (voir figure 1). La contraction ventriculaire augmente la pression artérielle des ventricules. Lorsque cette pression est supérieure à celle de l'aorte et des artères pulmonaires, la valve aortique et la valve pulmonaire s'ouvrent, pompant le sang dans le trafic systémique et pulmonaire respectivement. Dans le trafic systémique, le sang est pompé avec une saturation adéquate ou une quantité d'oxygène du ventricule gauche à l'artère aorte. De là, il est distribué à toutes les parties du corps jusqu'à atteindre les capillaires. Des aliments et des gaz sont échangés entre le sang et les tissus. En définitive, le sang laisse l'oxygène dans les tissus et reste avec le dioxyde de carbone. Ensuite, le sang passe des capillaires aux veines, de là aux vetas de cava supérieur et inférieur (SVC et IVC, en anglais supérieur vena cava et inférieur vena cava) et enfin à l'oreillette droite. Dans la circulation pulmonaire, le sang transportant du CO2 est canalisé du ventricule droit aux artères pulmonaires gauche et droite (LPA et RPA, left pulmonary artery et right pulmonary artery), des artères aux capillaires situées dans les alvéoles pulmonaires. Dans les Alvéoles, le sang va attraper O2 de l'air et le CO2 sera envoyé. Le sang passe des capillaires aux veines pulmonaires et atteint l'oreillette gauche. Le sang qui est arrivé aux oreillettes droite et gauche passe par la valve trimaxi et mitrale aux ventricules lorsque la pression des oreillettes est supérieure à celle des ventricules. Ensuite, avec le battement suivant, la trajectoire de la circulation sanguine reprendra, et ainsi de suite. Dans ce système circulatoire, la circulation systémique et la circulation pulmonaire sont bien différenciées, de sorte que le sang avec beaucoup d'O2 est bien séparé et avec une grande quantité de CO2 (voir figure 1). Bien que cet article explique la destination du sang, à chaque battement cardiaque il y a plusieurs phases qui ne seront pas expliquées ici: contraction isobolumétrique, éjection, etc. Son explication donnerait pour un autre article.
Patient monoventriculaire et trafic à Fonta
Ensuite, nous allons utiliser l'exemple d'un patient né avec une hypoplasie du cœur gauche pour expliquer le système circulatoire d'une personne avec un ventricule fonctionnel unique (voir figure 2 a)). Dans ce cas, le ventricule gauche n'a pas été suffisamment développé et ne peut pas pomper le sang. Par conséquent, le ventricule droit doit pomper le sang, à la fois à la circulation pulmonaire et systémique, grâce à la connexion entre les artères pulmonaires et l'aorte. En outre, la paroi entre les oreillettes est souvent perforée, de sorte que la circulation systémique et la circulation pulmonaire ne sont pas bien séparées, car le sang de l'un et de l'autre est confondu (voir figure 2 a)). De cette façon, l’oxygène n’est pas correctement distribué dans le corps [2].
Afin d’améliorer l’état de ces patients, Fontan et Baudet ont conçu en 1968 une opération pour séparer la circulation systémique de la circulation pulmonaire [3]. En lui, les chirurgiens, comme des plombiers, créent une structure en croix avec des vaisseaux sanguins. En fait, les veines de cava supérieure et inférieure se joignent aux artères pulmonaires gauche et droite, construisant ce qui est connu comme total cavopulmonary connection ou TCPC. Ils lient également l'aorte au ventricule (voir figure 2 b)). Ce nouveau système de circulation est connu sous le nom de trafic à Fontán.
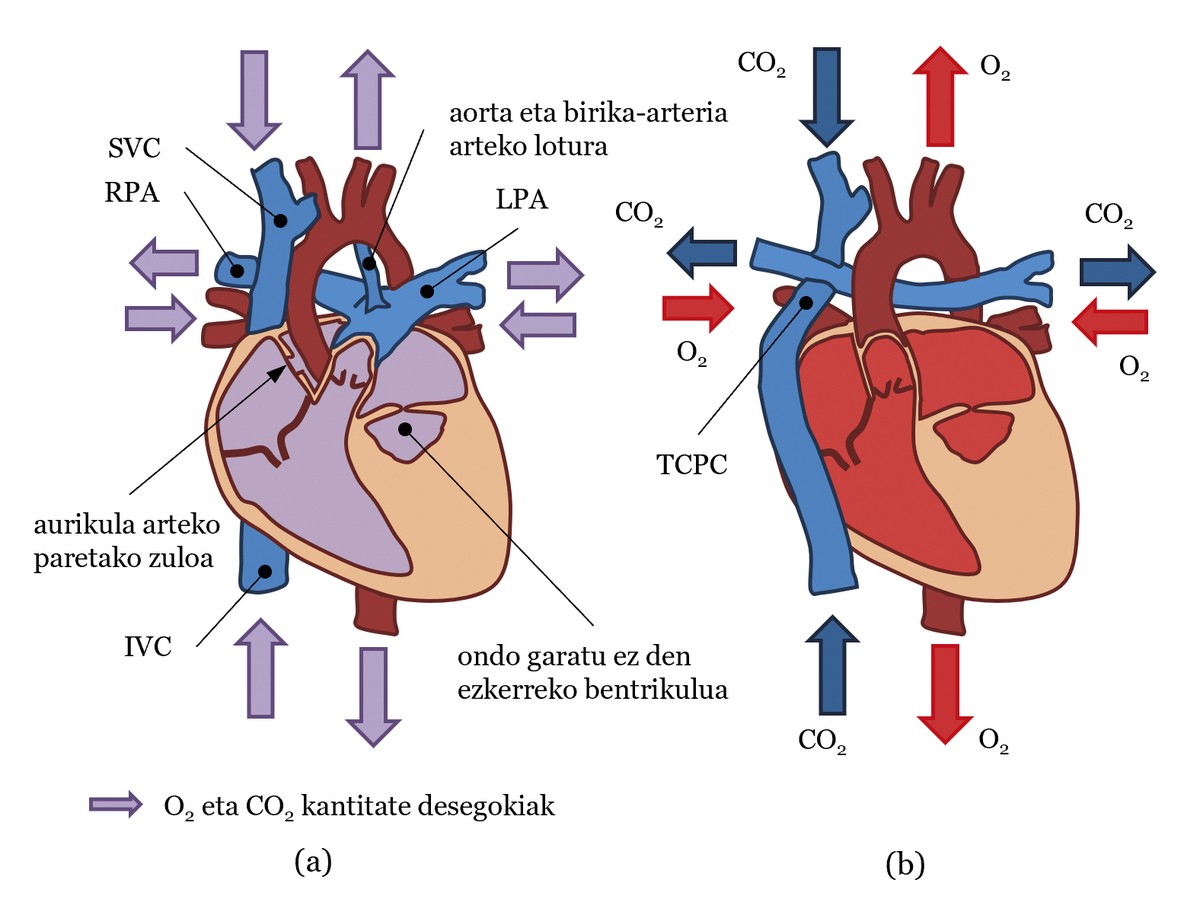
Dans la circulation de la Fontana, le ventricule qui travaille à chaque battement pompage à l'aorte un sang avec la quantité appropriée d'O2 qui atteint les tissus du corps pour l'échange O2/CO2. Ce sang arrivera par les veines au TCPC et par les veines cava se dirigera vers les artères pulmonaires sans passer par le cœur. Ainsi, le sang transportant du CO2 sera transféré dans les poumons et l'échange de CO2/O2 se produira dans les poumons. Enfin, le sang avec la bonne quantité d'O2 atteint le cœur par les veines pulmonaires. Dans le cœur, le sang passe de l'oreillette au ventricule et le ventricule bombe à l'aorte. Comme on peut le constater, le trafic systémique est séparé de celui des poumons. Un autre point important est que dans la circulation de Fontan le travail des deux doit être effectué par un seul ventricule, car le sang doit passer par la circulation systémique et par la circulation pulmonaire, ce qui augmente considérablement le travail du ventricule.
Améliorer la qualité de vie des patients à Fontan
Après l'intervention, et alors seulement, il faut analyser le bon fonctionnement de la circulation à la Fontana en analysant plusieurs métriques. En tout état de cause, il est aujourd'hui possible de prédire, en partie, comment sera la circulation à la Fontana. Une des façons de le faire est par des simulations de flux sanguin par ordinateur ou des simulations de CFD (computional fluid dynamics) [4]. En fait, un expert en dynamique des fluides, par exemple un ingénieur mécanique, serait en mesure de concevoir le TCPC optimal en collaboration avec les chirurgiens. Ainsi, le chirurgien serait obligé de réaliser une intervention compatible avec cette conception et de garantir le bon système circulatoire du patient.
Voici un exemple qui utilise des simulations CFD. Pour ce faire, nous analyserons deux modèles. Un, le modèle basé sur le TCPC d'un patient réel (ci-après le modèle A). L'autre, comme le modèle A, mais avec l'union de l'artère pulmonaire gauche à 27 mm. ci-dessous (modèle B ci-après) (voir figure 3 a)). Les simulations sont effectuées à partir du débit sanguin (ml/s) et de la pression (mmHg) mesurée sur le patient réel et les résultats sont analysés en fonction de deux caractéristiques. D'une part, la perte d'énergie du flux sanguin dans le TCPC. En ce qui concerne la perte d'énergie, rappelons qu'un seul ventricule fait le travail et que le TCPC est une structure créée par le chirurgien; si l'union n'est pas réalisée correctement, une perte d'énergie importante peut se produire. D'autre part, la distribution du flux sanguin dans les artères pulmonaires. Il est important que le flux sanguin soit réparti de manière équilibrée entre les artères pulmonaires de gauche et de droite, autour de 50% chacune. Il est également important de répartir équitablement les flux sanguins provenant des veines de cava supérieure et inférieure dans les deux artères pulmonaires. Par exemple, il est important qu’environ 50% de l’artère pulmonaire gauche provient de la veine cava inférieure et que l’autre moitié soit supérieure [4].
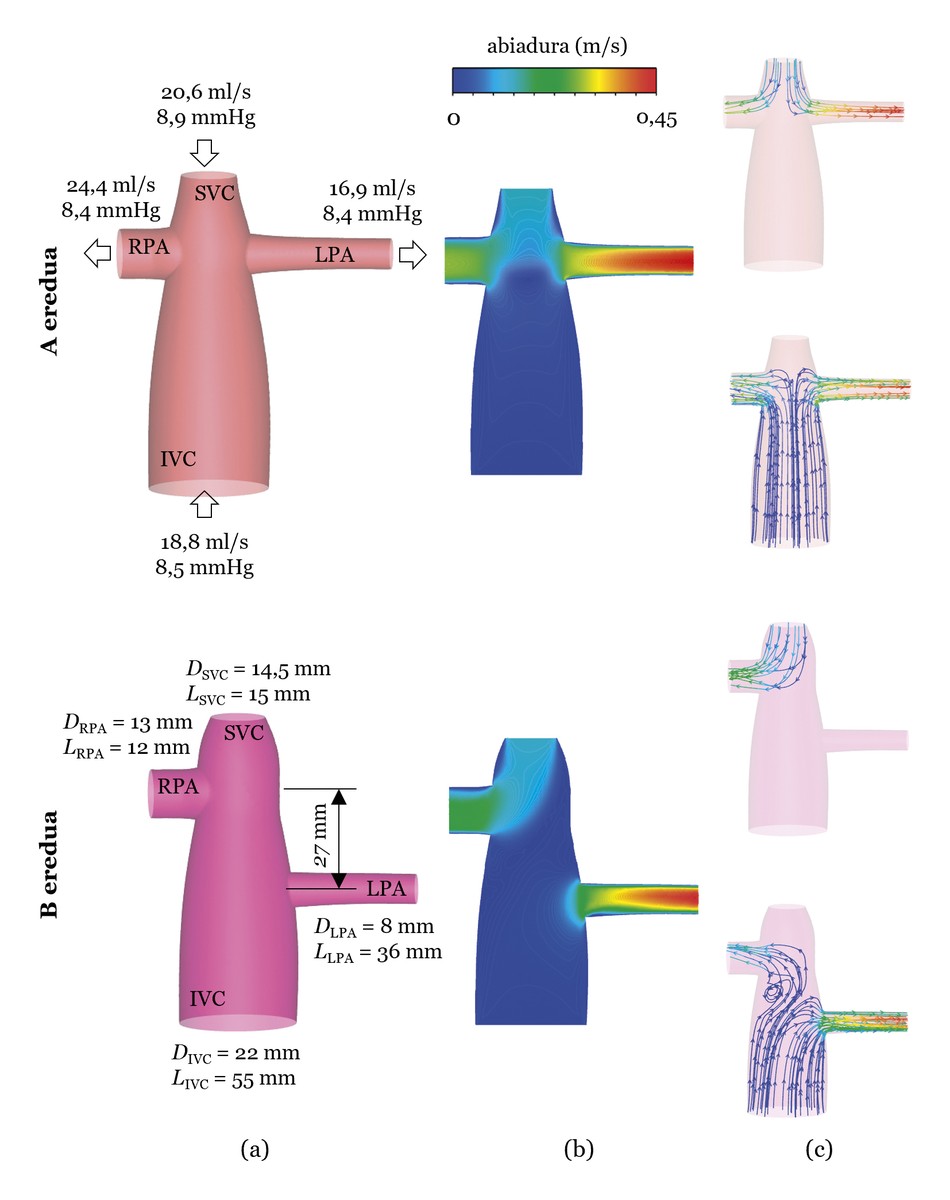
Les résultats des simulations sont présentés dans la figure 3 (b et c). En ce qui concerne la perte d'énergie, le modèle A pose une question de 2,6 % et le modèle B de 2,2 %. Le modèle B semble donc mieux, mais si l'on analyse la distribution des flux sanguins par les veines de cava, on constate que dans le modèle B tout le flux sanguin qui circule dans la cave supérieure est dirigé vers l'artère pulmonaire droite, de sorte que le sang qui circule dans la cave supérieure ne va pas au poumon gauche, ce qui peut causer des problèmes. Par conséquent, le modèle A est plus approprié, bien que la perte d'énergie soit supérieure à celle du modèle B, où la perte d'énergie est de 2,6%, mais peut être considérée comme très faible.
Cela montre que la géométrie du TCPC généré par le chirurgien influence le système de circulation du patient et que les simulations CFD par ordinateur peuvent être utiles pour la conception du TCPC optimal. Cependant, de nombreuses disciplines combinent l'ingénierie et la médecine à travers des simulations CFD. Par exemple, dans un article précédent, il a été expliqué que dans un traitement contre le cancer du foie, dans la radioembolisation, le travail des ingénieurs pouvait être important [5].
Enfin, il faut souligner que l'interdisciplinarité, en général, est très importante et nécessaire pour que des progrès soient réalisés dans tous les domaines. Parce que l'interdisciplinarité est la pluralité et la diversité est toujours la richesse.
Références
[1] Liu Y. Chen S., Zühlke L., Black G. C., Choy M., Li N. et Keavney B. - Bonbons, seigneur! 2019. “Global birth primence of congénitales heart déféts–2017: updated systems ematic review and meta-analysis of 260 studies”. International Journal of Épidéiology, 48, 455–463.
[2] Barron D. J., Kilby M. D., Davies B., Wright Le docteur G. C., Jones T. J. et Brawn W. J. 2009 Hypoplastic left heart syndrome. Lancet, 374, 551-564.
[3] Fontan F. et Baudet E. 1971. “Surgical repair of tricuspid atresia”. Thorax, 26, 240-248.
4] Slesnick T. Le grand C. 2017 “Role of computional modelling in planning and executing interventional procedures for congénitale heart disease”. Canadien Journal of Cardiology 33, 1159-1170.
[5] Aramburu J. 2018 « Ajouter des forces dans la lutte contre le cancer du foie ». Elhuyar, 329, 68-72.





