Corazones especiales, atención especial
Ingeniaritza Aplikatuan doktorea eta TECNUN - Nafarroako Unibertsitateko irakasle eta ikertzailea
Nuestro cuerpo es una máquina muy completa y eficiente; el corazón, el motor de esta máquina. A veces, sin embargo, el motor viene de la fábrica con alguna peculiaridad, por ejemplo con alguna enfermedad innata, como ocurre en 1 de cada 100 niños que nacen [1]. Esto influye directamente en el funcionamiento del cuerpo. En este artículo os voy a referir a la circulación de la sangre de las personas nacidas con un solo ventrículo funcional, desde el punto de vista de la mecánica de fluidos.
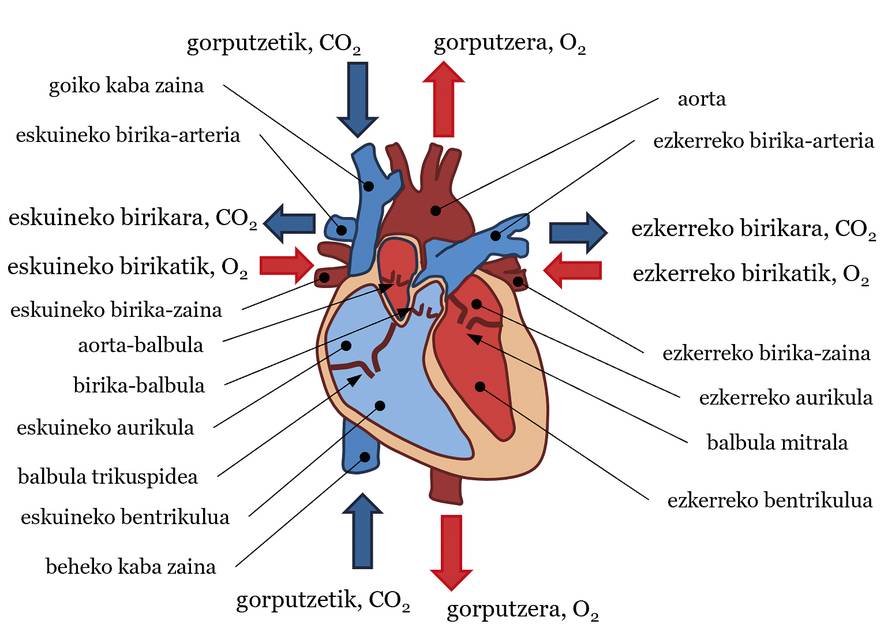
El sistema cardiovascular es una estructura muy compleja que consta de tres componentes básicos: corazón, sangre y vasos sanguíneos. En general, el corazón bombea la sangre y los vasos sanguíneos transportan la sangre a todas las partes del cuerpo para realizar diversas funciones de vital importancia. Entre esas obligaciones están la de llevar alimentos y oxígeno a los tejidos, combatir enfermedades, etc. Se suele decir que el corazón es nuestro motor y, como si de una bomba de agua se tratara, bombea sangre al sistema circulatorio. En cuanto a la estructura, el corazón puede dividirse en dos partes, la izquierda y la derecha, cada una con una aurícula y un ventrículo. Entre aurículas y ventrículos hay válvulas: válvula mitral en el corazón izquierdo y válvula tricúspide en el derecho. Asimismo, en la salida de los ventrículos se dispone de una válvula aórtica en el ventrículo izquierdo y una válvula pulmonar en el ventrículo derecho (ver figura 1). La sangre es también un fluido muy especial. El 55% de su volumen es fluido, el plasma —casi todo es agua— y el 45% restante está formado por partículas —casi todas son glóbulos rojos—. La dirección del flujo o movimiento de este fluido, es decir, el flujo sanguíneo, es la que va de las zonas de alta presión a las de menor presión. Por último, hay tres tipos de vasos sanguíneos: arterias, venas y capilares. Las arterias transportan la sangre del corazón al cuerpo, las venas del cuerpo al corazón y en los capilares se intercambian alimentos y gases entre la sangre y los tejidos. Uniendo este último dato a la idea de presión, en general la sangre tiene más presión en las arterias que en las venas.
En este sistema, los latidos cardíacos marcan el ritmo del flujo sanguíneo. De manera sencilla, podemos describir la trayectoria del flujo sanguíneo en cada latido (ver figura 1). La contracción ventricular aumenta la presión sanguínea de los ventrículos. Cuando esta presión es superior a la de la aorta y de las arterias pulmonares se abren la válvula aórtica y la válvula pulmonar, bombeando sangre al tráfico sistémico y pulmonar respectivamente. En el tráfico sistémico se bombea sangre con una adecuada saturación o cantidad de oxígeno desde el ventrículo izquierdo hasta la arteria aorta. Desde aquí se distribuye a todas las partes del cuerpo hasta llegar a los capilares. Allí se intercambian alimentos y gases entre la sangre y los tejidos. En definitiva, la sangre deja el oxígeno en los tejidos y se queda con el dióxido de carbono. Después, la sangre pasa de los capilares a las venas, de ahí a las vetas de cava superior e inferior (SVC e IVC, en inglés superior vena cava y inferior vena cava) y, finalmente, a la aurícula derecha. En la circulación pulmonar, la sangre que transporta CO2 se canaliza desde el ventrículo derecho a las arterias pulmonares izquierda y derecha (LPA y RPA, left pulmonary artery y right pulmonary artery), desde las arterias hasta las capilares situadas en los alvéolos pulmonares. En los Alvéolos, la sangre cogerá O2 del aire y se enviará CO2. La sangre pasa de los capilares a las venas pulmonares y llega a la aurícula izquierda. La sangre que ha llegado a las aurículas derecha e izquierda pasa por la válvula tricúspide y la mitral a los ventrículos cuando la presión de las aurículas es superior a la de los ventrículos. A continuación, con el siguiente latido, se reanudará la trayectoria del flujo sanguíneo, y así sucesivamente. En este sistema circulatorio se encuentra bien diferenciada la circulación sistémica y la circulación pulmonar, por lo que la sangre con una gran cantidad de O2 está bien separada y con una gran cantidad de CO2 (ver figura 1). Aunque en este artículo se ha explicado el destino de la sangre, en cada latido cardíaco hay varias fases que no se van a explicar aquí: contracción isobolumétrica, eyección, etc. Su explicación daría para otro artículo.
Paciente monoventricular y tráfico en Fonta
A continuación, utilizaremos el ejemplo de un paciente que ha nacido con hipoplasia del corazón izquierdo para explicar el sistema circulatorio de una persona con un ventrículo funcional único (ver figura 2 (a)). En este caso, el ventrículo izquierdo no se ha desarrollado lo suficiente y no puede bombear sangre. En consecuencia, el ventrículo derecho debe bombear sangre, tanto a la circulación pulmonar como sistémica, gracias a la conexión existente entre las arterias pulmonares y la aorta. Además, la pared que hay entre las aurículas suele estar perforada, por lo que la circulación sistémica y la circulación pulmonar no están bien separadas, ya que la sangre de uno y otro se confunde (véase figura 2 (a)). De esta manera, el oxígeno no se distribuye correctamente a través del cuerpo [2].
Con el objetivo de mejorar el estado de estos pacientes, Fontan y Baudet diseñaron en 1968 una operación para separar la circulación sistémica de la circulación pulmonar [3]. En él, los cirujanos, como si fueran fontaneros, crean una estructura en cruz con vasos sanguíneos. De hecho, las venas de cava superior e inferior se unen a las arterias pulmonares izquierda y derecha, construyendo lo que se conoce como total cavopulmonary connection o TCPC. También unen la aorta al ventrículo (ver figura 2 (b))). Este nuevo sistema de circulación se conoce con el nombre de tráfico en Fontán.
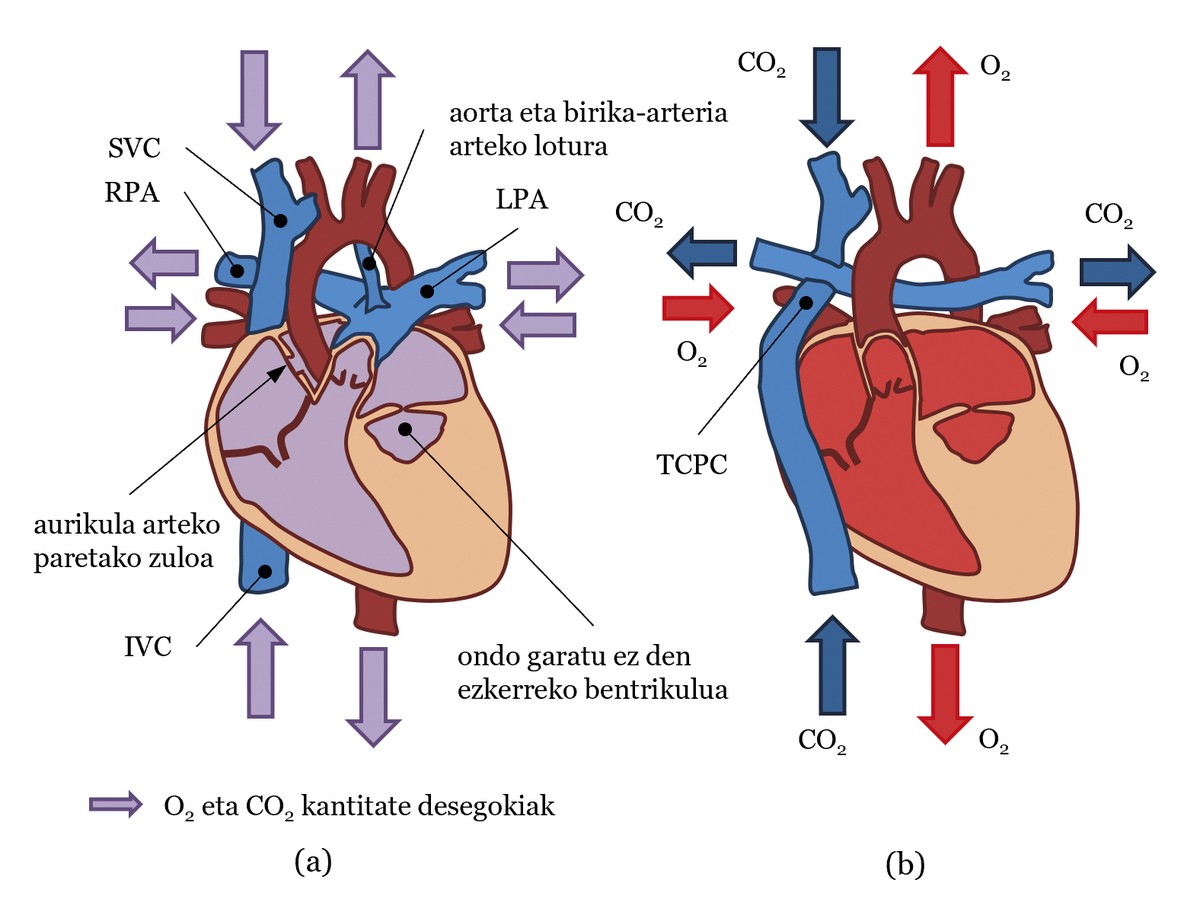
En la circulación de la Fontana, el ventrículo que trabaja en cada latido bombea a la aorta una sangre con la cantidad adecuada de O2 que llegue a los tejidos del cuerpo para que se produzca el intercambio O2/CO2. Esta sangre llegará por las venas al TCPC y por las venas cava se dirigirá a las arterias pulmonares sin pasar por el corazón. Así, la sangre que lleva CO2 se trasladará a los pulmones y se producirá el intercambio de CO2/O2 en los pulmones. Por último, la sangre con la cantidad adecuada de O2 llega al corazón por las venas pulmonares. En el corazón, la sangre pasa de la aurícula al ventrículo y el ventrículo bombea a la aorta. Como se puede observar, el tráfico sistémico está separado del de los pulmones. Otro punto importante es que en la circulación de Fontán el trabajo de los dos debe ser realizado por un solo ventrículo, ya que la sangre debe pasar por la circulación sistémica y por la circulación pulmonar, lo que aumenta considerablemente el trabajo del ventrículo.
La mejora de la calidad de vida de los pacientes en Fontan
Tras la intervención, y solo entonces, hay que analizar el correcto funcionamiento de la circulación en la Fontana analizando varias métricas. En cualquier caso, hoy en día es posible predecir, en parte, cómo va a ser la circulación en la Fontana. Una de las formas de hacerlo es mediante simulaciones de flujo de sangre por ordenador o simulaciones de CFD (computational fluid dynamics) [4]. De hecho, un experto en dinámica de fluidos, por ejemplo, un ingeniero mecánico, sería capaz de diseñar el TCPC óptimo en colaboración con los cirujanos. De este modo, el cirujano se vería obligado a realizar una intervención compatible con dicho diseño y a garantizar el correcto sistema circulatorio del paciente.
A continuación se muestra un ejemplo que utiliza simulaciones CFD. Para ello, analizaremos dos modelos. Uno, el modelo basado en el TCPC de un paciente real (en adelante, el modelo A). La otra, igual que el modelo A, pero con la unión de la arteria pulmonar izquierda a 27 mm. más abajo (en adelante, modelo B) (véase la figura 3 (a))). Las simulaciones se realizarán a partir del flujo sanguíneo (ml/s) y la presión (mmHg) medidos en el paciente real y se analizarán los resultados en función de dos características. Por un lado, la pérdida de energía del flujo sanguíneo en el TCPC. En cuanto a la pérdida de energía, recordemos que un solo ventrículo hace el trabajo y que el TCPC es una estructura creada por el cirujano; si la unión no se realiza correctamente, se puede producir una pérdida de energía importante. Por otro lado, la distribución del flujo sanguíneo en las arterias pulmonares. Es importante que el flujo sanguíneo se distribuya de forma equilibrada entre las arterias pulmonares de la izquierda y la derecha, en torno al 50% cada una. También es importante repartir equilibradamente los flujos sanguíneos procedentes de las venas de cava superior e inferior en las dos arterias pulmonares. Por ejemplo, es importante que aproximadamente el 50% de la arteria pulmonar izquierda proceda de la vena cava inferior y que la otra mitad sea la superior [4].
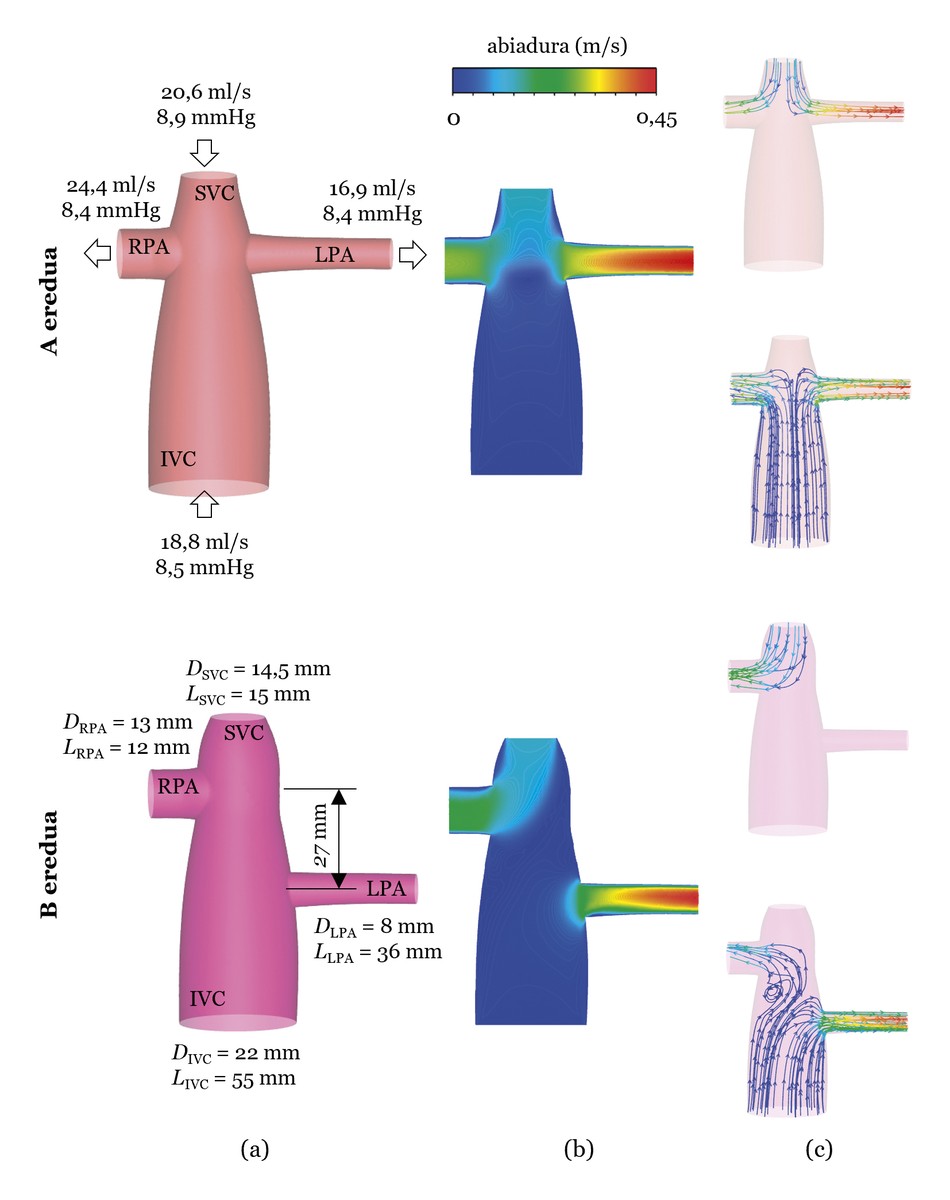
Los resultados de las simulaciones se pueden ver en la figura 3 (b y c). En cuanto a la pérdida de energía, en el modelo A se produce una pregunta del 2,6% y en el modelo B del 2,2%. El modelo B parece, por tanto, mejor, pero si se analiza la distribución de los flujos sanguíneos por las venas de cava, se observa que en el modelo B todo el flujo sanguíneo que circula por la cava superior se dirige a la arteria pulmonar derecha, por lo que la sangre que circula por la cava superior no va al pulmón izquierdo, lo que puede causar problemas. Por lo tanto, el modelo A es más adecuado, aunque la pérdida de energía es mayor que en el modelo B, donde la pérdida de energía es del 2,6%, aunque puede considerarse muy baja.
Esto demuestra que la geometría del TCPC generado por el cirujano influye en el sistema de circulación del paciente y que las simulaciones CFD por ordenador pueden ser útiles para el diseño del TCPC óptimo. Sin embargo, son numerosas las disciplinas que combinan la ingeniería y la medicina a través de simulaciones CFD. Por ejemplo, en un artículo anterior se explicó que en un tratamiento contra el cáncer de hígado, en la radioembolización, el trabajo de los ingenieros podía ser importante [5].
Por último, hay que subrayar que la interdisciplinariedad, en general, es muy importante y necesaria para que se produzcan avances en todos los ámbitos. Porque la interdisciplinariedad es la pluralidad y la diversidad es siempre la riqueza.
Referencias
[1] Liu Y., Chen S., Zühlke L., Black G. C., Choy M., Li N. y Keavney B. -¡Caramba, señor! 2019. “Global birth prevalence of congenital heart defects–2017: updated systems ematic review and meta-analysis of 260 studies”. International Journal of Epidemiology, 48, 455–463.
[2] Barron D. J., Kilby M. D., Davies B., Wright El doctor G. C., Jones T. J. y Brawn W. J. 2009. Hypoplastic left heart syndrome. Lancet, 374, 551-564.
[3] Fontan F. y Baudet E. 1971. “Surgical repair of tricuspid atresia”. Thorax, 26, 240-248.
4] Slesnick T. El gran C. 2017. “Role of computational modelling in planning and executing interventional procedures for congenital heart disease”. Canadian Journal of Cardiology 33, 1159-1170.
[5] Aramburu J. 2018. “Sumando fuerzas en la lucha contra el cáncer de hígado”. Elhuyar, 329, 68-72.





