Électrolytes polymères de batteries dans la chasse aux anions
Que se passerait-il si une batterie ne pouvait stocker qu'une partie de l'énergie utilisée pour charger ? Ou si seulement une petite partie de l'énergie que vous enregistrez pourrait passer à l'appareil mobile ? Les réactions latérales à l'intérieur de la batterie ont beaucoup à voir à ce sujet, et trouver un électrolyte polymère approprié peut aider à améliorer l'efficacité de la batterie.

Lorsque, en 1991, Sony a lancé pour la première fois des batteries ion-lithium (VOL), les portes de la révolution des appareils portables ont été ouvertes. Grâce à ces batteries, nous avons étendu les téléphones mobiles, tablettes et ordinateurs portables que nous utilisons actuellement. Cependant, comme les besoins énergétiques augmentent, il est nécessaire de faire un pas de plus.
Si dans l'anode de ces batteries on utilise le métal lithium (Li0) au lieu de graphite, sa capacité se multiplierait par dix. Le lithium métallique, cependant, est très réactif et a des problèmes en les combinant avec des électrolytes liquides inflammables et volatiles. En définitive, il est plus facile que des réactions se produisent entre un liquide et un solide que entre deux solides. Ainsi, lorsque des électrolytes liquides sont utilisés avec l'électrode Li0, la probabilité de réaction latérale est plus élevée.
Une solution est l'utilisation d'électrolytes polymères solides. En ce sens, María Martínez et ses co-auteurs du CIC Energigune ont récemment publié dans la revue Advanced Functional Materials, que l'ajout d'un peu de sel LiFSI au lithium d'environ 2%) améliore considérablement les caractéristiques de l'électrolyte polymère PSTFSI/PEO.
Électrolyte, pont entre électrodes
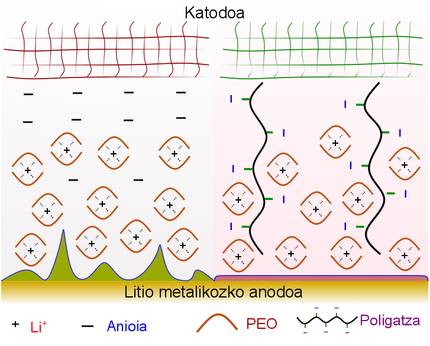
Dans les électrolytes liquides ou électrolytes conventionnels, les simples cations et anions ont une grande mobilité, ce qui peut provoquer la polarisation de l'électrolyte. Autrement dit, rapprocher les cations de l'électrode négative et empiler les anions autour de l'électrode positive, ce qui permet de créer des zones de charge partielle positive et négative dans l'électrolyte. Dans ces cas, les sorties dites dendrites sont créées à l'anode au lithium métallique. Si les dendrites traversent l'électrolyte et atteignent l'autre électrode, des courts-circuits provoquant danger et perte d'énergie sont produits.
Pour résoudre ce problème, on utilise actuellement des électrolytes avec des polymères solides qui entravent la création de dendrites. En tout cas, comme mentionné dans la publication des chercheurs du CIC Energigune, il faut qu'il y ait quelque chose qui empêche la mobilité des anions de l'électrolyte. Ainsi, dans les électrolytes polymères qui ne sont que des conducteurs d'ions lithium-ion (SLIC), l'anion se lie de façon convalente à un tronc polymère qui rend la mobilité difficile. Par conséquent, dans ces cas, la polarisation de l'électrolyte est évitée et seul le cations au lithium (Li+) peut se déplacer vers l'électrode.
Électrolyte polymère LiPSTFSI/PEO
De nombreuses études ont été menées sur l'électrolyte polymère solide LiPSTFSI/PEO. En général, on peut dire que le polyéthylène est un polygone au lithium du tronc de polystyrène (PS) étendu en oxyde (PEO). Cet électrolyte, cependant, présente une faible conductivité ionique. C'est parce que le PEO et le PS associé à l'anion ne sont pas intrinsèquement interactifs, ce qui rend difficile la dissolution du sel LiPSTFSI.
En outre, entre l'électrode Li0 et l'électrolyte, une surface très résistante au lithium est créée. Étant donné que la fonction de l'électrolyte des batteries au lithium est de transporter les cations Li+ de l'électrode à l'électrode, les deux caractéristiques réduisent l'efficacité des batteries.
L'équipe de recherche a pu constater que lorsqu'on ajoute un peu de sel LiFSI à cet électrolyte polymère (seulement 2%), la conductivité des ions Li+ à l'intérieur de l'électrolyte augmente considérablement. En fait, le RMN à l'état solide (SSNMR) et la spectroscopie Raman ont pu constater que l'ajout de ce sel facilite l'interaction entre l'oxyde de polyéthylène et le polystyrène du tronc de l'électrolyte et la dissolution du LiPSTFSI. Dans cette situation, la conductivité ionique est principalement due aux cations au lithium, car l'anion est piégé car il est lié au polystyrène et interagit avec le polyéthylène.
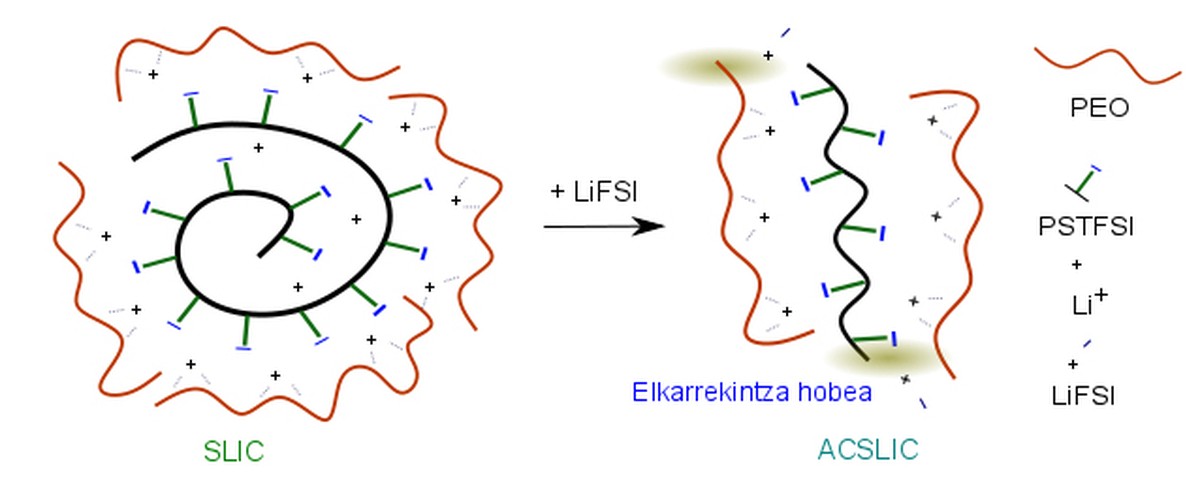
Il a également été prouvé que l'ajout de ce sel réduit la résistance au lithium dans l'interface électrode/électrolyte. Grâce aux calculs théoriques, on a pu constater que le sel LiFSI se réduit à la surface de l'électrode au lithium métallique et que LiF est généré. La présence de LiF sur la surface du métal lithium facilite considérablement le mouvement du cations au lithium.
Et en utilisant sur batterie…
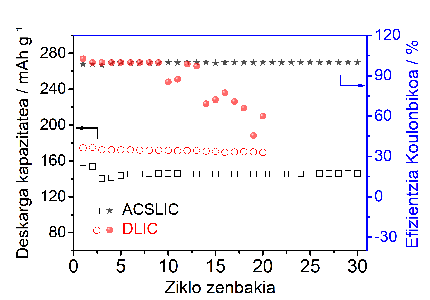
Expérimentalement, ils ont pu démontrer qu'avec cet électrolyte polymère, il faudrait deux fois plus de temps pour créer des dendrites dans l'anode au lithium métallique et produire un court-circuit dans la batterie.
En utilisant cet électrolyte polymère solide sur une batterie à cathode LiFePO4, la batterie est plus efficace qu'avec d'autres électrolytes polymères. De plus, ce polymère électrolyte peut également être utilisé pour d'autres cathodes à haute tension.
En outre, ce qui a été fait par l'équipe de recherche de CIC EnergiGUNE (à savoir doper l'électrolyte polymère avec une petite quantité de sel) est plus simple et économique que synthétiser d'autres électrolytes polymères.
Bibliographie:
Martínez M., Sánchez E., Qiao L., Zhang Y. Judez X, A. Santiago, Aldalur I, D. Carrasco, Ed. Zhu, Forshit M., Armand M., Zhang H.; Unprécédent Improvement of Single Li-Ion Conductive Solid Polymer Electrolyte Through Salt Additive; Adv. Fun. Mat. (2020)





