Carreira de barreiras de medicamentos
O home sempre buscou sustancias que curan ou alivian as enfermidades. Nun principio obtíñanse principalmente de plantas e animais, pero desde a Segunda Guerra Mundial, a síntese química e a biotecnoloxía axudaron á maioría dos novos medicamentos. Na
obtención e comercialización dun novo medicamento interveñen especialistas en áreas tan diversas como a química, a bioloxía molecular, a farmacia básica e clínica, a economía e a estatística. Ao labor intelectual hai que engadir o diñeiro, xa que se sabe que as industrias farmacéuticas obteñen enormes beneficios grazas a una serie de prestixiosos medicamentos, pero tamén é certo que as investigacións son custosas e duran moitos anos. Cando se comercializa un medicamento poden pasar entre 10 e 15 anos e a investigación pode custar entre decenas e centos de millóns de euros.
Procura da molécula motriz
A procura dun novo medicamento comeza coa procura de posibles compoñentes activos. O compoñente activo é o corazón do fármaco, con efectos farmacolóxicos. Antes, a maioría obtíñanse das plantas: ao ver que os efectos dunha planta sobre os animais e sobre os seres humanos eran favorables, concluíase que servía paira curala. Posteriormente, tentouse identificar e illar o compoñente activo das plantas utilizadas tradicionalmente en medicamento, co fin de sintetizalo no laboratorio.
Paralelamente, empezáronse a realizar e probar novas moléculas con potencial curativo, pero a procura era cega, non estaba baseada no método científico.
Na actualidade, a procura baséase no coñecemento dos mecanismos da enfermidade. Sabendo que a enfermidade provoca cambios bioquímicos e celulares, os investigadores tratan de buscar as sustancias que afrontan estes cambios. Trátase de identificar o receptor e sintetizar a molécula que o une. Desta forma, ao asociar esta molécula ao receptor, conséguese aumentar ou inhibir a actividade que a célula tería de seu mesma.
Noutras ocasións, o obxectivo é mellorar una molécula que xa se coñece e paira iso ponse a proba os cambios estruturais; en ocasións, basta con modificar lixeiramente a estrutura paira aumentar considerablemente a eficiencia ou convertela en apta paira outro uso.
Tamén pode ocorrer que atopemos aleatoriamente o compoñente activo dun medicamento novo. Así ocorreu, por exemplo, coa penicilina. A historia é coñecida: Mentres Alexander Fleming traballaba co virus da gripe, descubriu que nalgunhas culturas bacterianas algo impedía a proliferación da bacteria Staphylococcus, una cultura bacteriana que estaba enlucida e que o culpable era una sustancia do moho. E así descubriu a penicilina, o antibiótico máis utilizado durante moitos anos.
Claudio Palomo, catedrático da Facultade de Química da UPV/EHU en Donostia, considera que o instinto ten una gran importancia na procura de novos fármacos. De feito, na sección de Química Orgánica está a probarse una molécula achada ao azar; aínda que a investigación atópase nas primeiras fases, os resultados son moi satisfactorios.
Con todo, non todo se pode atribuír ao azar; o descubrimento de Fleming tivo lugar en 1928, pero tanto en 1875 como en 1925 outros investigadores que escribiron que o moho tiña un efecto antibacteriano, pero non foron capaces de profundar máis. Así que paira atopar un novo medicamento, a sorte non é suficiente.
Primeiras probas

En todos os casos, o seguinte paso é sintetizar uns gramos. Con eles realízanse as primeiras probas da molécula candidata. A miúdo as moléculas son moi efectivas nos ensaios, pero moi poucas superan as probas previas ao comezo dos ensaios clínicos e, por suposto, son menos as que chegan ao final. Segundo datos de EE.UU., dos 5.000 compostos que comezan a estudarse no laboratorio, só cinco chegan a probalo en humanos. E só uno deste cinco é o suficientemente eficaz e seguro como paira acceder á clínica médica.
O obxectivo das primeiras probas é coñecer en detalle as características do compoñente activo: características físico-químicas, estabilidade, solubilidad, etc. Ademais, analízase in vitro a influencia do compoñente mediante sistemas non celulares (en preparados encimáticos) e cultivos celulares animais ou humanos.
Primeiros pasos na Facultade de Química de San Sebastián da UPV

En Euskal Herria, a universidade, o hospital e o laboratorio traballan xuntos paira conseguir novos medicamentos. O departamento de Química Orgánica da Facultade de Química da UPV/EHU é un dos participantes neste traballo. É aquí onde se dá o primeiro paso, é dicir, búscanse novos compoñentes activos.
Teñen varias vías de procura. Hai uns anos desenvolveron una metodoloxía propia de creación de péptidos. Os péptidos son moléculas formadas por 3-4 aminoácidos que, aínda que pequenos, poden influír. Agora mesmo estase estudando un destes péptidos. Segundo o profesor Iñaki Gamboa, o proceso non é nada fácil, pero se cre que se salgue ben é un paso importante.
Farmacolóxico a medicamento
Paira avanzar hai que dar outro paso importante: facer o medicamento co fármaco. Normalmente considéranse sinónimos o fármaco e o medicamento, pero segundo explica José Luís Pedraz, catedrático da Facultade de Farmacia da UPV/EHU en Vitoria-Gasteiz, non son o mesmo: o fármaco é una molécula de efecto farmacolóxico que o preparado paira curar.

O labor dos farmacéuticos consiste na elaboración dun preparado co que se poidan administrar pacientes. O preparado, ademais de poder ser inxerido por unha ou outra vía, debe cumprir outras características como ser estable, desprender o compoñente activo tras a súa administración e ser capaz de accionar. Todo isto non é nada fácil e poida que teña que prescindir dunha molécula candidata efectiva porque non se pode preparar o medicamento. Pedrat cre que uno dos desafíos da farmacoloxía actual é que os xenes ou fragmentos de ADN e moléculas potentes, sexan capaces de converterse en medicamentos. E é que, aínda que poden ser moi útiles paira curar enfermidades, aínda non é posible tomalas como outros medicamentos.
Cando se consegue preparar o medicamento coa molécula motriz, comezan as probas de toxicidade nos animais. As primeiras sesións realízanse co rato, por unha banda porque ao ser pequenas non son necesarias grandes cantidades e por outro, porque existen procedementos regulados no rato paira medir a toxicidade. Posteriormente realízanse probas con animais de maior tamaño.
Nestas sesións analízase o intervalo entre a dose letal e a efectiva; canto maior é o intervalo, máis seguro é o medicamento. Ademais, obsérvanse os efectos adversos que se manifestan, tanto de forma inmediata como a longo prazo, como en xeracións futuras
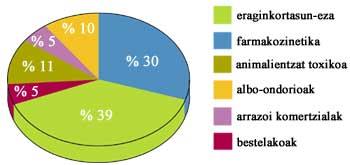
Medindo a seguridade do fármaco no ser humano
Cando os resultados de todas as probas anteriores son satisfactorios, hai que ver que efecto ten o medicamento no ser humano. Paira iso realízanse sesións clínicas e analízanse os efectos terapéuticos e os efectos adversos. En función dos resultados, determínase si serve ou non paira a terapia e, si é válido, determínanse as doses e a posología (cando e en cantos).
As sesións clínicas divídense en catro fases en función dos obxectivos. Os obxectivos principais destas catro fases son, respectivamente, a análise da seguridade, a medición da eficiencia, a comparación con outros medicamentos e o seguimento e profundización nas investigacións una vez comercializadas.
Nunha primeira fase, por tanto, débese demostrar que o medicamento é seguro. A importancia desta fase é enorme, xa que até entón esta sustancia nunca foi probada en humanos. E se os resultados non son bos, a investigación suspéndese inmediatamente. As probas realízanse con voluntarios sans e hai que destacar que son conscientes do que pode causar este medicamento e que poden abandonalo cando o desexen.
Nos inicios das sesións clínicas o máis difícil é decidir que dose utilizar. O punto de partida son os experimentos con animais, cunha dose inicial do 1-2% do efectivo nos animais e una dose máxima do 10-16% do máximo permitido polos animais. Nos primeiros estudos adminístrase una única dose, e tras ver o que ocorre decídese si dar a seguinte ou non. Aos poucos a dose aumenta ata que se detectan efectos inaceptables.
Co menor número de participantes posible (30-100) preténdese obter a máxima información posible. Paira ver como o corpo toma a medicación, mídense as constantes vitais e a actividade cardíaca e realízanse análise de sangue e ouriños. Posteriormente realízanse estudos farmacodinámicas (medicamentos e os seus efectos sobre o corpo) e farmacocinéticos (como afecta o metabolismo do corpo ao fármaco) e obsérvase a súa interacción con outros alimentos e/ou fármacos. Todo iso demostra si é seguro ou non. As probas tamén serven paira decidir cando e como administralas.
Unidade de Desenvolvemento Farmacéutico de Vitoria-Gasteiz

O traballo iniciado na Facultade de Química de San Sebastián podería continuar na Facultade de Farmacia de Vitoria-Gasteiz. En concreto, dentro da Fundación LEIA, a Unidade de Desenvolvemento Farmacéutico está formada polo Departamento de Farmacia e Tecnoloxía Farmacéutica e a Unidade de Ensaios Clínicos do Hospital de Txagorritxu.
Na Facultade de Farmacia estudan as moléculas candidatas e definen as súas características. Se ven que una molécula é válida, preparan o medicamento. Posteriormente, na Unidade de Ensaios Clínicos do Hospital de Txagorritxu realízanse sesións con voluntarios da primeira fase. As análises de sangue e ouriños que se deben realizar tamén se realizan nesta sección de Farmacia. Se todo vai ben pasan á segunda fase das sesións clínicas, pero paira iso necesitan a colaboración doutros hospitais.
Ademais, en Vitoria-Gasteiz prepáranse e proban os medicamentos xenéricos, algúns dos cales se comercializan a través do laboratorio Litaphar de Azpeitia.
Seguro si, pero... é eficaz?

Nunha segunda fase analízase a curación do medicamento. Até entón só se mirou á seguridade, pero a non afección non significa que se beneficie. Nunha segunda fase realízanse probas paira comprobar o posible efecto beneficioso e determinar as normas e doses máis adecuadas paira a administración do medicamento.
A segunda fase dura entre un e tres anos e require a participación de entre 100 e 400 persoas, algunhas delas pacientes. Finalmente coñécese a relación dose-efecto. Nas sesións sempre hai un grupo de control e os exames adoitan ser aleatorios e cegos, é dicir, o participante non sabe si está a tomar o medicamento ou o placebo. Ás veces realízanse sesións dobres cegas, é dicir, o investigador que dá o medicamento aos participantes tampouco sabe o que está a tomar. Desta maneira, os resultados son máis obxectivos.
Última fase pre-comercial
A terceira fase recolle as últimas probas realizadas antes da comercialización do medicamento. Nesta fase compárase o medicamento con outros medicamentos xa existentes no mercado e de igual uso terapéutico. Ademais, os exames realízanse coma se os pacientes estivesen en situación normal, é dicir, deben tomar a dose na mesma hora e no mesmo estado en que deberían tomar a medicación, seguir coa actividade normal e a comida...

Non hai que esquecer que o medicamento está dirixido a pacientes. Por iso, os voluntarios da terceira fase deben substituír o mellor posible aos pacientes que van recibir o medicamento. Con todo, non sempre é fácil, xa que a realización de probas con enfermos, vulnerables, nenos, anciáns e embarazadas xera problemas éticos.
Estes equipos son máis vulnerables que o resto, polo que algúns investigadores exclúenos das probas. A sobreprotección, con todo, non adoita ser beneficiosa porque a poboación excluída nos ensaios, se algún día necesita este medicamento, ninguén saberá cal será o seu efecto.
Á marxe disto, hai que ter moi claro que se quere conseguir na terceira fase, canto tempo e canto diñeiro quérese gastar. De feito, moitos novos medicamentos son máis eficaces que os existentes, pero hai que ver até que punto a diferenza é tan grande que moitas veces non é moi grande. Nestes casos, quizais sexa mellor suspender a investigación, xa que a diferenza non merece tanto diñeiro e tempo.
Tras o despedimento hai que seguir investigando

Con toda a información recompilada nas tres primeiras fases das sesións clínicas, elabóranse os informes de solicitude de autorización de comercialización. Tendo en conta onde se quere comercializar, os informes envíanse á Axencia Española do Medicamento, á Axencia Europea ou á Administración de Alimentos e Medicamentos (FDA) de EE.UU. para que, tras unha análise exhaustiva, autoricen ou deneguen o despedimento.
Pero á hora de decidir, moitas veces pasa moito tempo, xa que a miúdo piden que se completen os datos ou que se fagan máis probas. Segundo Lidia Larrañaga, directora técnica do laboratorio Litaphar de Azpeitia, no caso dos medicamentos xenéricos este proceso dura aproximadamente un ano. Loxicamente, cando o medicamento é completamente novo, o proceso de obtención da autorización alárgase moito.
Una vez autorizado, o medicamento salgue ao mercado. É entón cando comeza a cuarta fase das sesións clínicas. O obxectivo desta fase é o seguimento da eficacia e seguridade do medicamento. Bastantes veces ocorre, por exemplo, que as doses establecidas son demasiado altas, polo que se volve a publicar con doses máis baixas. En menor medida, poden aparecer efectos secundarios graves nalgún grupo da poboación que non foron detectados en sesións clínicas. Isto pode obrigar a retirar o medicamento do mercado.
Outras veces, grazas aos estudos que se realizan nesta fase, atópanse novos usos. Por exemplo, a aspirina leva 105 anos no mercado. Ao principio saíu paira eliminar a dor e tratar as inflamacións, pero agora sábese que tamén é beneficioso paira previr os infartos e estanse realizando probas paira utilizalo na loita contra o cancro.
Está claro que o lanzamento dun novo medicamento é un traballo penoso, longo e caro. A cambio, hai remedios contra moitas enfermidades. No entanto, en ocasións abúsase da medicación e a toma de medida depende do médico e de cada un.
O futuro comeza hoxe
XX. A farmacoloxía do século XX avanzou moito grazas á química, a farmacoloxía e a clínica. A partir de agora, os expertos creen que os avances se centrarán na bioloxía molecular, o xenoma e a proteoma, a biotecnoloxía, a química combinatoria, a bioinformática e a robótica.

Sen dúbida, a identificación dos xenes supuxo una nova forma de entender as enfermidades. Coñecendo o control xenético das funcións da célula, ábrense novas vías paira previr ou curar enfermidades. Independentemente da terapia génica, o coñecemento do xenoma leva a descubrir os destinos dos novos medicamentos. Proteómica, pola súa banda, analiza o produto do xenoma, polo que complementa ao anterior.
Doutra banda, existen diferenzas entre os grupos étnicos á hora de metabolizar os medicamentos, e é posible que un medicamento que beneficia á maioría poida causar danos a algúns. A farmacogenética estuda a relación entre o genotipo individual e a capacidade de metabolización dos medicamentos.
A química combinatoria supuxo un gran avance na química de síntese. A tecnoloxía actual permite obter moléculas de interese máis rápido que nunca. Paira coñecer cales destas moléculas son realmente de valor terapéutico utilízanse métodos rápidos de cribado de alta eficacia. Así, coñécense con precisión e rigor os distintivos de entre 50.000 e 60.000 moléculas á semana. Todo iso débese á bioinformática como ferramenta imprescindible paira a rápida comprensión e tratamento de tantos datos.
Con todo, non deben evitarse as sustancias naturais con capacidade curativa. Até o momento só se explotou o 10% dos recursos da Terra, polo que aínda quedan moitos tesouros ocultos. Paira ser conscientes da súa importancia, basta con ver cales son os medicamentos máis vendidos, como a ciclosporina, a lobastatina, a claritromicina, a pravatatina e a altobastatina, nove dos dez medicamentos non proteicos que máis se venderon ano pasado en EE.UU.





