Quand Einstein a heurté la lumière

En 1905, Einstein a expliqué l'effet photoélectrique. Pour cela, il a dû se fonder sur la théorie des quanta. Pour analyser l'histoire de la découverte du quantique, il faut d'abord regarder en arrière. Il faut analyser le débat sur la nature de la lumière.
En 1801, le physicien anglais Thomas Young voulait mieux comprendre ce qu'est la lumière. Jusqu'alors, Newton disait que la lumière était composée de petites particules. Mais Young a fait passer la lumière par deux fentes et, comme les vagues flottantes, il a vu qu'il se divisait. Je déduis donc que la lumière est l'onde. Einstein a donné raison à tous les deux quand il a expliqué l'effet photoélectrique.
Effet photoélectrique
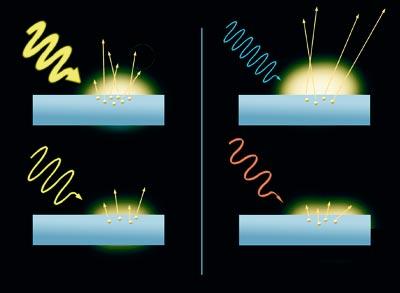
C'est un effet curieux. Lorsque les rayons de lumière frappent sur la surface d'un métal, les électrons sont retirés. C'est l'effet photoélectrique. En outre, le résultat varie en fonction de la couleur des rayons. Les électrons libérés par la lumière bleue se déplacent plus vite que ceux libérés par la lumière rouge. En fait, plus l'énergie du rayon de lumière (celle de la lumière bleue est supérieure à celle de la lumière rouge), plus le mouvement des électrons est rapide. D'autre part, le nombre d'électrons libérés du métal dépend de l'intensité de la lumière, à plus grande intensité de la lumière, plus grand nombre d'électrons. Cependant, la lumière ne libère pas d'électrons sans énergie minimale.
Il est parti de la théorie d'Einstein Planck. Cette théorie tient compte du fait que la lumière est l'onde, qu'elle a une fréquence et que la fréquence est proportionnelle à l'énergie.
La vague est un exemple simple. La fréquence est l'intervalle de temps entre une vague et la suivante; plus l'intervalle est long, plus la fréquence est basse. En revenant à la lumière, la lumière rouge a moins de fréquence que le bleu, donc, selon la théorie de Planck, l'énergie est beaucoup plus faible. En fait, les électrons fortement unis ne peuvent pas être libérés par des radiations à basse fréquence. Ils ont besoin de beaucoup d'énergie.

Ainsi, en 1905, il a donné une explication détaillée de l'effet photoélectrique. Supposant que les électrons libérés ont certains niveaux d'énergie, comme Planck, le jeune Albert Einstein a proposé qu'avec le rayonnement, il en va de même. Einstein a réalisé que les deux énergies sont liées à l'effet photoélectrique, de sorte que le choc doit être interprété comme un choc entre deux particules, à savoir que la lumière agit comme une balle de billard. Il a appelé photon à la particule de lumière et a réclamé que l'énergie du photon est proportionnelle à la fréquence de la lumière, comme dans le cas de l'onde. Donc, selon l'hypothèse d'Einstein, la lumière est à la fois des particules et des ondes.
C'est l'explication par laquelle Einstein a reçu le prix Nobel de physique de 1921 et non par la théorie de la relativité, bien que, sans doute, cette théorie et le reste de ses contributions à la physique ont été importants. Ils gagnent probablement le prix Nobel.

Le travail gagnant du Prix Nobel de physique est intitulé: Über einen die Erzeugung und Verwandlung des Lichts betreffen heuristischen Gesichtspunkt (Du point de vue heuristique, sur la production et la transformation de la lumière). En plus de donner une explication de l'effet photoélectrique, il est un travail de base pour la physique quantique, très révolutionnaire, selon l'auteur.
Cependant, bien que Einstein avait une grande importance au début de la théorie quantique, la vraie révolution quantique était XX. Il a commencé dans le deuxième quart du siècle et Einstein n'a pas.
Einstein a dit que la lumière peut non seulement agir comme une onde, mais comme une particule, tandis que Louis de Broglie a affirmé que les particules peuvent également agir comme des ondes. Mais que signifiait cela ? Que toute matière a la nature ondulatoire. Oui, vous pouvez jouer comme des vagues vos chaises, chiens, arbres ou vous-même. Logiquement, quand il s'agit de corps très grands, la nature ondulatoire n'a pas de force, donc cet effet n'est pas remarqué dans la matière que nous voyons, mais au niveau atomique et inférieur. C'est-à-dire, si un faisceau d'électrons se fait passer par un mur avec deux fentes, comme les vagues de la mer (et non comme les boules de billard) interféreront entre elles, c'est-à-dire qu'elles se comportent sous forme d'ondes. La preuve en sont quelques-unes des techniques les plus répandues aujourd'hui comme le microscope électronique.

des particules et des ondes.
À partir de ce moment, nous ne pouvons pas distribuer le concept de particule et d'onde. Non. On peut dire que ce sont deux perspectives du même concept. Dans certains cas, la matière apparaît sous forme de particules ou de corpuscules et dans d'autres sous forme d'ondes. Ils ont passé des années jusqu'à ce que les physiciens ont accepté ces conclusions.
Ce travail a été la base de la nouvelle branche de la physique développée grâce à la théorie du quantum: la physique quantique. La contribution d'Einstein est prise comme le véritable point de départ de la physique quantique, puisque Planck n'a apporté que le concept de ce qui. Plus tard, à partir du travail de Planck et d'Einstein, de nombreux physiciens ont donné une interprétation surprenante à la physique quantique.
Aller aux atomes
Parmi ceux qui ont donné une nouvelle orientation à la théorie quantique, souligne Niels Bohr. Le physicien danois a appliqué aux atomes la théorie qui était appliquée au rayonnement. C'est-à-dire qu'il a cultivé le modèle atomique. À leur avis, les électrons des atomes ne pouvaient avoir aucune énergie. Autour du noyau, ils se déplaçaient sur plusieurs taches, chacune avec un certain niveau d'énergie. Plus l'électron du noyau est proche, plus l'énergie est nécessaire pour l'évacuer.
Le modèle atomique de Bohr est planétaire, c'est-à-dire que les électrons tournent en orbite autour du noyau. Selon Bohr, les orbites électroniques sont stables et se produisent à certains niveaux énergétiques, c'est-à-dire que leurs énergies sont quantifiées.

Par exemple, lorsque l'hydrogène est chauffé dans un récipient fermé et transparent, il émet de la lumière appelée spectre d'émission d'hydrogène. Le modèle de Bohr explique très bien pourquoi la lumière émise est de certaines couleurs ou fréquences, et non blanche (si toutes les couleurs de lumière seraient blanches). Tout cela est lié aux niveaux d'énergie discrète ou quantifiée des électrons.
Cependant, le modèle de Bohr ne peut expliquer que le spectre de l'hydrogène. Bien que adapté à l'atome d'hydrogène, il n'était pas en mesure d'expliquer le spectre atomique des systèmes composés de deux électrons. En fait, le modèle de Bohr ne montrait que des atomes d'un seul électron. Et pourtant, ce n'est pas peu, ne le pensez pas! Au contraire, grâce à Bohr, les portes ont été ouvertes et les autres physiciens ont pu analyser des atomes plus compliqués.
La révolution quantique a pris 15 ans de plus à apparaître les spectres atomiques des éléments multi-électrons. Cela signifiait, en outre, la disparition du modèle atomique planétaire.
En 1926, Schrödinger publie la célèbre équation qui porte son nom. Le modèle atomique planétaire a été dépassé, car cette équation montre que les électrons se comportent sous forme d'onde dans les atomes. Par conséquent, on ne peut pas parler d'orbites d'électrons, car une onde n'est pas dans un endroit physique déterminé, mais dans une zone plus large. Et cela n'est pas appelé orbite, mais orbitale. Autrement dit, l'orbital nous donne la probabilité de trouver des électrons dans un endroit. Par conséquent, au lieu de parler des orbites des électrons, il faut parler de la probabilité de trouver des électrons.
Sans aucun doute, toutes ces théories sont le fruit des travaux réalisés par Planck et Einstein. La physique théorique a fait de grands pas, mais il n'est pas resté dans une simple théorie. Il avait de nombreuses applications. Ces apps surprendraient aussi Einstein.
Fission, fille de la relativité
Empreinte dans les romansActuellement, il semble que les Prix Nobel de physique sont plus distribués, pour ainsi dire. En fait, au cours des dernières années ont été récompensés des œuvres de différents domaines de la physique, tels que les superconducteurs, les neutrinos cosmiques, les condensats Bose-Einstein, etc. Tous sont des thèmes très différents. Autrefois, au fil de l'année, les sujets liés à l'effet photoélectrique ou la nature de l'atome étaient ceux qui ont reçu le plus de prix. Tout a commencé en 1918 avec Planck. En 1921 Einstein a reçu le prix Nobel de physique pour l'explication de l'effet photoélectrique. Cependant, l'effet photoélectrique et la physique quantique n'ont pas été intacts. Les physiciens ont continué à travailler et avec de bons résultats. L'année suivante, en 1922, Bohr a reçu le prix Nobel de physique. Einstein a appliqué la théorie appliquée à la lumière aux atomes, c'est à dire proposé le modèle atomique. En 1923, Millikan a reçu, entre autres, le prix pour confirmer les deux théories précédentes. En 1925, il a été recueilli par Franck et Hertz pour étudier les chocs entre les électrons et les atomes. Elle fut donnée à Broglie en 1929 pour découvrir la nature ondulatoire des électrons. Selon cela, en plus de la lumière, toute matière peut agir comme une onde. En 1932, par la voie de la mécanique quantique, il a également été attribué Heisenberg. En 1933, Schrödinger et Dirac ont été récompensés pour le développement du modèle atomique soulevé par Bohr. Le premier, par exemple, a écrit l'équation mathématique qui donnait forme d'onde ou d'information de toute particule. Comme vous pouvez le constater, l'empreinte de l'effet photoélectrique sur les prix Nobel de physique n'est pas petite. Il est significatif. Pendant plusieurs années, des travaux liés directement ou indirectement à ce sujet ont été récompensés. |





