Cèl·lules mare: agents de la biomedicina del futur
Què són les cèl·lules mare i quins efectes terapèutics tenen?
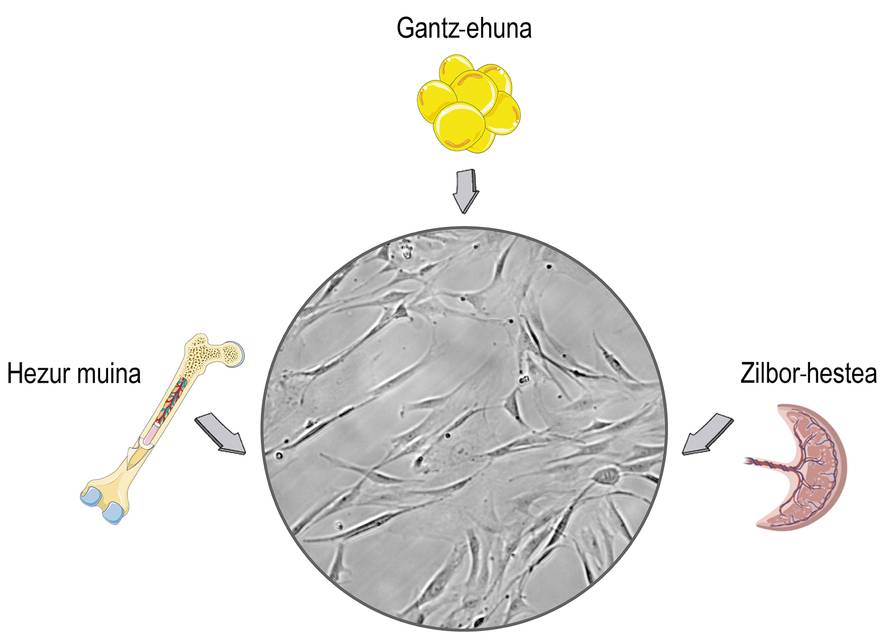
Les cèl·lules mare són cèl·lules que es troben en els teixits estromales dels mamífers. Segurament relaciones el seu ús amb debats ètics i religiosos, i aquesta preocupació està relacionada amb el seu origen. Les cèl·lules mare es poden aïllar dels teixits embrionaris, la qual cosa pot causar problemes morals. El problema és que les cèl·lules mare també les podem obtenir dels organismes madurs i deixar de costat aquests problemes. En conseqüència, en la majoria de les recerques s'aïllen dels donants adults, principalment del cordó umbilical, la medul·la òssia i el teixit adipós (Figura 1).
La motivació principal de l'ús d'aquestes cèl·lules són les seves característiques terapèutiques. Entre elles, la més coneguda és la seva capacitat de transformació cap a altres tipus de cèl·lules. Segons el nombre de tipus de cèl·lules que es poden distingir, es classifiquen en quatre classes: (1) totipotentes, que poden diferenciar-se en totes les cèl·lules dels teixits embrionaris i no embrionaris (placenta) i que tenen la capacitat de formar un organisme complet; (2) pluripotentes, que poden distingir-se en les cèl·lules de tots els llinatges embrionaris; (3) multipotentes, que només es distingeixen en les cèl·lules del lli embrionari del seu origen; i (4) unipotentes, que es diferencien en un únic tipus de cèl·lules. Gràcies a aquesta capacitat, les cèl·lules mare tenen un gran potencial per a curar i regenerar teixits. El seu ús s'ha estudiat en profunditat en la renovació òssia i cartílag.
A més d'aquesta capacitat regenerativa, les cèl·lules mare tenen un altre efecte terapèutic important: poden regular el sistema immunitari. Encara que la seva acció inmunomoduladora és el resultat d'una complexa combinació de diversos mecanismes, els factors bioactivos que produeixen i alliberen les cèl·lules són considerats com els principals responsables d'aquesta activitat. Entre elles es troben les interleucas, els enzims metabòlics, els factors de creixement i les quimioquinas, que interactuen amb les cèl·lules immunes i regulen el seu efecte.
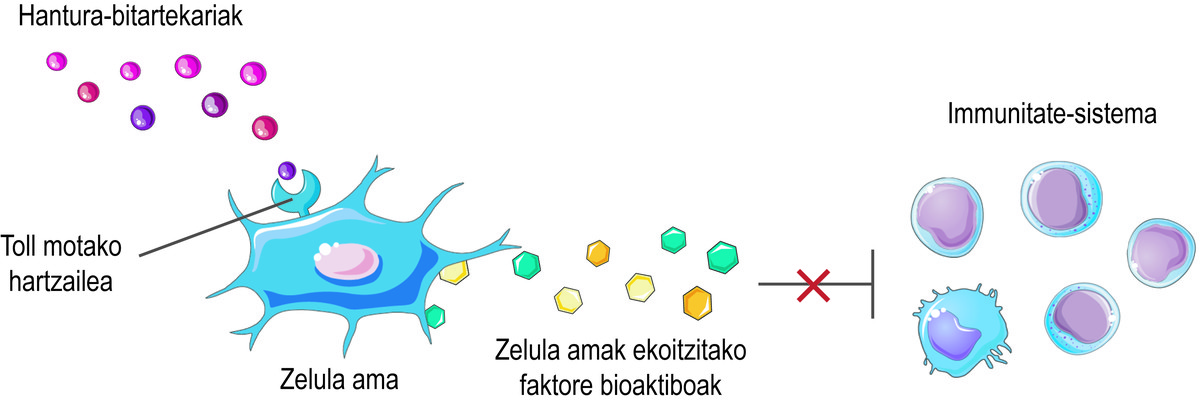
Però, com saben que les cèl·lules mare han d'alliberar els factors bioactivos? Les cèl·lules mare perceben el que està succeint en la seva micromedio a través dels seus receptors de tipus Toll en superfície, tractant d'equilibrar la situació. Per exemple, en l'inici d'una lesió, perceben que hi ha pocs intermediaris inflamatoris en el mitjà i la consideren un senyal d'activació del sistema immunitari. En conseqüència, les cèl·lules mare segreguen diversos factors bioactivos que activen la resposta immune per a iniciar el procés de curació d'aquesta lesió. A mesura que el sistema immunitari compleix la seva funció, allibera mediadors inflamatoris. D'aquesta forma, quan es realitza el procés, el nivell dels citats mediadors inflamatoris és elevat. En detectar-ho, les cèl·lules mare alliberen factors bioactivos que inhibeixen la resposta immune i afavoreixen la curació i homeòstasi dels teixits (Figura 2).
Tenint en compte la sobreactivación del sistema immunitari en moltes malalties, les cèl·lules mare s'han convertit en una excel·lent alternativa terapèutica. De fet, reduint la resposta immune ataquen l'origen de la malaltia. Entre altres coses, s'ha estudiat en profunditat l'ús de cèl·lules mare per a tractar la malaltia de l'empelt versus hostal, la malaltia inflamatòria intestinal o l'esclerosi múltiple, obtenint resultats esperançadors.
Reptes a superar per a aconseguir la translació clínica de cèl·lules mare
Malgrat ser una teràpia prometedora, cal superar alguns reptes per a acostar els tractaments basats en cèl·lules mare a la clínica. D'una banda, és urgent optimitzar els protocols de lliurament. Després de l'administració intravenosa, el sistema immunològic de l'hoste elimina les cèl·lules mare en poc temps i redueix considerablement l'efectivitat de la teràpia. A més, un percentatge important de les cèl·lules queda emmagatzemat en els capil·lars pulmonars, mentre que la resta s'expandeix en el cos. Això pot causar problemes de seguretat.
D'altra banda, com ja s'ha esmentat anteriorment, la presència de mediadors inflamatoris és imprescindible perquè les cèl·lules mare inhibeixin la influència del sistema immunitari. El problema és que en moltes malalties el grau d'aquests intermediaris és escàs, per la qual cosa les cèl·lules no reben senyals per a alliberar els factors bioactivos que limiten la immunitat. Per això, en l'actualitat, la comunitat científica està realitzant un gran esforç per a desenvolupar estratègies que promoguin les capacitats inmunomoduladoras de les cèl·lules mare. Entre les alternatives destaca l'estimulació de cèl·lules mare amb intermediaris inflamatoris, és a dir, l'estimulació inflamatòria. En concret, s'ha demostrat que en estimular cèl·lules mare amb interferó gamma (ifn-{), factor necrosi del tumor alfa (tnf-?) o altres mediadors inflamatoris similars abans d'administrar-se, millora notablement l'alliberament de certs factors bioactivos. No obstant això, l'efecte d'aquesta estimulació és efímer i desapareix en el futur. Desgraciadament això no és suficient per a tractar malalties cròniques, per la qual cosa és imprescindible trobar estratègies que mantinguin l'efecte regulador de les cèl·lules mare a llarg termini.
Sistemes de donació que afavoreixen l'acció terapèutica de cèl·lules mare
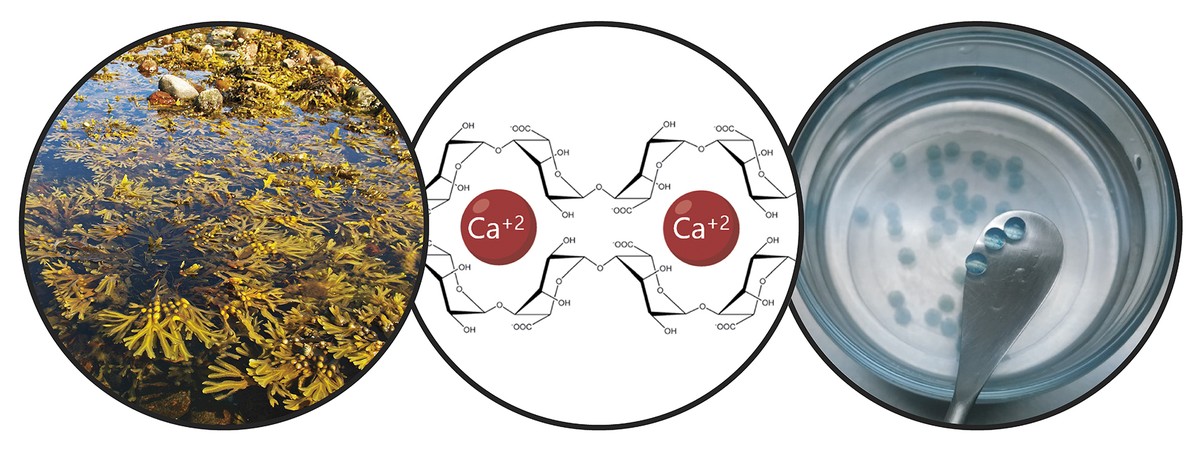
Tenint en compte les limitacions esmentades, l'objectiu principal de la tesi ha estat el desenvolupament d'un sistema de donació que impulsa la retenció de cèl·lules mare i l'acció terapèutica a llarg termini. En concret, en aquest nou sistema de donació hem combinat dues estratègies. D'una banda, per a garantir la retenció de les cèl·lules i fomentar la seva viabilitat, les hem encapsulat en un hidrogel. Un hidrogel és una estructura reticular tridimensional amb cadenes flexibles, en el nostre cas d'alginato. L'alginato és un polímer natural que es troba en les algues marrons. Entre els avantatges que ofereix l'alginato destaquen la biocompatibilitat, la baixa toxicitat i la capacitat de formar hidrogels en condicions normals. Aquestes característiques són imprescindibles en la tecnologia d'encapsulat cel·lular. Els alginatos hidrogelaspueden preparar-se utilitzant diversos mètodes de reticulació, però el més utilitzat és l'encreuament iònic entre cadenes de polímers i cations divalentes, que sovint es realitza a través del calci (Figura 3). Els hidrogels obtinguts presenten un alt contingut en aigua i similituds mecàniques amb els teixits tous. En el nostre cas, en aquesta xarxa tridimensional que genera l'alginato hem inclòs el col·lagen, ja que en imitar el micromedio natural de les cèl·lules es fomenta la seva viabilitat.
Aquests hidrogels poden aplicar-se en més d'un lloc del cos, com la cavitat peritoneal o la pell. Una vegada administrat, l'implant quedarà en aquesta posició i garantirà la retenció cel·lular. D'altra banda, l'hidrogel protegeix a les cèl·lules mare del sistema immunitari de l'hoste, evitant l'entrada de cèl·lules immunes i anticossos. En aquest punt és important determinar que l'estructura polimèrica de l'hidrogel permet la difusió dels factors bioactivos alliberats per les cèl·lules mare. D'aquesta forma, el nostre sistema permet mantenir les cèl·lules encapsulades en l'emplaçament donat i alliberar de manera sostenible els factors bioactivos. De fet, en els assajos preclínicos que hem realitzat amb els ratolins, els hidrogels que encapsulen cèl·lules mare s'han mantingut a llarg termini sota la pell. De fet, en recuperar els implants 45 dies després de la seva col·locació, hem analitzat les cèl·lules i hem comprovat que continuen vius.
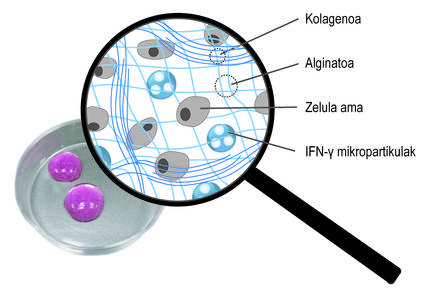
A més de l'encapsulació tridimensional, hem utilitzat una segona estratègia per a promoure l'acció terapèutica de les cèl·lules. En concret, la idea ha estat estimular constantment cèl·lules mare amb mediadors inflamatoris. Per a això, s'han inclòs en la xarxa tridimensional de la xarxa d'alginato-col·lagen hidrogel micropartículas esfèriques carregades amb el mediador ifn-{ (Figura 4). Els nostres estudis han demostrat que aquest sistema combinat permet mantenir un microambiente inflamatori continu. Així, les cèl·lules mare produeixen durant més temps factors bioactivos que inhibeixen el sistema immunitari. D'altra banda, s'ha comprovat que en conrear cèl·lules mare encapsulades en aquests nous hidrogels amb cèl·lules del sistema immunitari, s'inhibeix l'efecte d'aquestes últimes. Això demostra el bon funcionament del sistema.
En general, aquest nou sistema de donació que conjumina totes dues estratègies, a més d'impulsar i prolongar l'acció terapèutica de les cèl·lules, garanteix la seva retenció i viabilitat, la qual cosa pot implicar importants implicacions en teràpies basades en aquestes cèl·lules.
Bibliografia
J. Galipeau and L. Sensebe, Cell. Stem Cell. 2018, 22, 824-833 (DOI:10.1016/j.stem.2018.05.004).
L. J. Scott, BioDrugs, 2018, 32, 627-634 (DOI:10.1007/s40259-018-0311-4).
C. Muroi, K. Miyamura, M. Ocada, T. Yamashita, M. Murata, T. Ishikawa, N. Uike, M. Hidaka, R. Kobayashi, M. Imamura, J. Tanaka, K. Ohashi, S. Taniguchi, T. Ikeda, T. Eto, M. Mori, M. Yamaoka and K. Ozawa, Int. J. Hematol, 2016, 103, 243-250 (DOI:10.1007/s12185-015-1915-9).
A. Gonzalez-Pujana, K. H. Vining, D. C. I. Zhang, E. Santos-Vizcaino, M. Igartua, R. M. Hernandez and D. J. Mooney, Biomaterials, 2020, 257, 120266 (DOI:S0142-9612(20)30512-3).
J. R. Ferreira, G. Q. Teixeira, S. G. Santos, M. A. Barbosa, G. Almeida-Porada and R. M. Goncalves, Front. Inmunol, 2018, 9, 2837 (DOI:10.3389/fimmu.2018.02837).
A. Gonzalez-Pujana, M. Igartua, E. Santos-Vizcaino and R. M. Hernandez, Symphone Opin. Drug Deliv. 2020, 17, 189-200 (DOI:10.1080/17425247.2020.1714587).





