État spécial de la matière: hélium superfluide
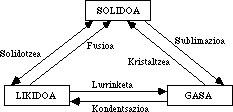
Grâce à l'amélioration des techniques, les chercheurs ont eu la possibilité de travailler à des températures élevées et ont trouvé un état ionique qui a donné lieu au deuxième état gazeux appelé plasma. Ensuite, les astronomes, avec la découverte des étoiles à neutron, ont donné lieu à un deuxième état solide appelé matière hyperdense. La capacité de travailler à des températures très basses a donné lieu au deuxième état liquide, appelé état superfluide. Il défie les lois les plus cohérentes de l'état liquide, dont l'interprétation, même au niveau atomique, est très difficile et discutée.
Dans ce petit travail nous parlerons de l'état superfluide de l'hélium, le superfluide le plus rare que les physiciens ont trouvé.
Caractéristiques de l'hélium
Il a été découvert par les astronomes au soleil et a ensuite été identifié parmi les gaz les plus rares dans l'atmosphère. L'hélium qui peut être trouvé dans l'atmosphère est principalement 4 2 He, étant l'isotope 3 2 He dans un pourcentage de 10-7%.
En 1868, l'hélium a été découvert dans l'atmosphère du soleil grâce au photographe. Il pourrait être obtenu en chauffant certains minéraux dans la terre. Jusqu'à l'exploitation des gisements de gaz naturel, la production d'hélium était très réduite, mais suffisante pour les besoins de laboratoire.
Au niveau atomique, bien que celle de l'hélium après l'hydrogène soit très simple (deux protons, deux neutrons, deux électrons), comme nous l'avons dit précédemment, c'est le superfluide qui adopte le comportement le plus rare.
Hélium superfluide
Vers 1900, les chercheurs ont commencé à traiter tous les gaz connus.
Comme on le sait, tout gaz peut être liquéfié et solidifié dans des conditions adéquates par refroidissement jusqu'à une température déterminée. Plus la pression sur le gaz est élevée, plus la température de liquéfaction est élevée. Par exemple, le propane et le butane peuvent être liquéfiés par simple compression dans une bouteille à température ambiante. Par conséquent, dans la liquéfaction d'un gaz, nous pouvons profiter à la fois de la pression et de la température pour atteindre notre objectif.
Bien que travaillant à très basse pression en pratique, la liquéfaction de la plupart des gaz nécessite des températures très basses, avec une limite de zéro absolue (-273,16°C = OK). En effet, l'oxygène sous pression atmosphérique nécessite une température de -218°C, l'azote -210°C, le chlore -101°C et le néon -248°C. Malgré la difficulté de la liquéfaction d'autres gaz, avec le temps et surtout en raison des progrès de la technique, la liquéfaction de tous les gaz a été obtenue. Un des gaz que présentait cette difficulté était l'hydrogène, dont la température de liquéfaction (-260°C) est très basse. Par conséquent, la température de liquéfaction de l'hydrogène, très proche du zéro absolu, a grandement entravé les chercheurs, obtenant James Dewar en 1892.
Comme nous le savons tous, quand les molécules sont stagnantes (c'est-à-dire quand il n'y a pas de mouvement moléculaire), l'énergie cinétique et donc la température prennent la valeur zéro. Dans le zéro absolu, il n'y a pas de mouvement moléculaire. Par conséquent, aucune molécule ne peut atteindre un état zéro absolu.
Ainsi, comme nous l'avons dit au début de ce petit travail, nous nous situerons dans l'hélium. En 1900, tous les gaz, sauf l'hélium, ont été liquéfiés. Bien que toutes les voies de liquéfaction de l'hélium ont été travaillées, d'une part, il ne pouvait pas être liquéfié et encore moins solidifié, et d'autre part, les chercheurs qui l'ont fait pensé qu'il ne pouvait être en état gazeux, indépendamment de sa valeur de pression et de température.
En fait, la première affirmation est correcte, car seulement par refroidissement l'hélium ne peut pas se solidifier. Et quant à la deuxième affirmation, il faut dire que ce n'est pas un gaz durable, mais le plus difficile à liquider. La liquéfaction de l'hélium a été obtenue par le physicien néerlandais Kammerling Onnes en 1908. Par conséquent, tous les gaz pouvaient être liquéfiés en payant ce qui signifiait travailler à basse température. Cette découverte a encouragé les chercheurs à apprendre les caractéristiques de l'hélium liquide. Depuis qu'ils ont commencé à étudier ces caractéristiques, ils ont vu qu'ils étaient très étonnants, sans pouvoir expliquer leur comportement.
Pour commencer, la température de liquéfaction de 4 2 He est la plus petite connue sous pression normale (1 atm): -268,82°C (4,18K), soit quatre degrés Celsius au-dessus du zéro absolu. 3 En ce qui concerne le He 2, la température de liquéfaction est inférieure : -270°C (3,2K). Bien que la température diminue complètement, jusqu'à 0,001K, par exemple, sous pression environnementale on ne peut pas solidifier les deux isotopes de l'hélium.
Les liquides obtenus aux températures indiquées ont les caractéristiques de tous les liquides, mais si la température diminue, ils arrivent tous les deux à l'état de superflu. 3 Le He atteint l'état de superfluide à la température 0,001K. Quant au 4H, il atteint son état de superfluide à une température de 2,17 K. Aujourd'hui, les Finlandais ont les bons outils pour obtenir des températures aussi basses et les maintenir pendant longtemps. Dans les lignes suivantes, nous nous concentrerons particulièrement sur les caractéristiques de l'isotope de l'hélium atomique à 4 pesos, qui présente les caractéristiques les plus particulières.
Cet isotope de l'hélium produit un liquide à une température de 4,18K, appelé He 1. Comme mentionné précédemment, une diminution de la température autour de la température de 2,17K provoque l'He à subir une curieuse transformation à laquelle il se produit un changement dans ses caractéristiques physiques. Cette transformation semble être une solidification, mais elle reste liquide. Si la température de 2,17 K est atteinte, le 4He prend un état de superfluide et cette nouvelle forme est appelée He II.
Quelles sont les particularités de Hélium II?
Au-dessus du mur
La viscosité est la propriété de tous les fluides, tant des gaz que des liquides. La viscosité représente la friction interne du fluide, qui transmet les effets d'un mouvement à travers le fluide en rejoignant la direction du fluide. L'unité est le poème (P).
La viscosité de l'eau à 25°C est de 0,01 P. Les liquides pâteux ont une viscosité très élevée et les cristaux sont infinis. En revanche, les gaz présentent une viscosité très faible. L'hélium superfluide n'a pas de viscosité, c'est-à-dire il est complètement fluide (fluide parfait).
Par exemple, une goutte d'huile glisse dans un verre plus lentement qu'une goutte d'eau. Par conséquent, l'huile a une viscosité supérieure à l'eau. Mais l'hélium superfluide connu baisse beaucoup plus vite que tout liquide normal. Une goutte d'hélium superfluide glisserait dans le verre aussi vite qu'une boule de plomb tombée dans l'air d'une certaine hauteur.
Par contre, contrairement aux liquides normaux, tout objet qui se déplace à l'intérieur de l'hélium superfluide ne trouve aucune friction.
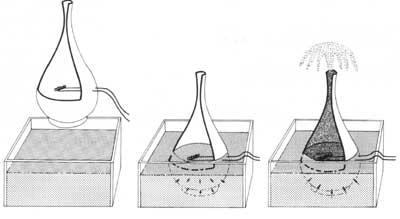
Selon une loi de mécanique des fluides, plus le diamètre en mouvement d'un fluide est grand, plus il s'écoule rapidement. Au contraire, He II adopte un comportement totalement opposé; dans des tubes de petit diamètre, il se déplace plus vite que dans les grands. Ce comportement nous amène à une expérience curieuse: si nous remplissions une carafe en céramique non émaillée avec de l'hélium superfluide, il irait très vite par le mur. L'eau serait dans le pot. Par conséquent, He II est un fluide si parfait qui passe par les pores microscopiques de la terre brûlée.
Mais si nous le conservons dans un emballage poreux, que se passerait-il ? On pourrait penser que He II resterait là, c'est-à-dire qu'il n'irait pas parce qu'il n'y a pas de pores. Cependant, cela ne se produit pas ; il commence à monter par la paroi intérieure du récipient et descend par la paroi extérieure comme si chaque molécule s'en allait en escaladant un mur. Le processus se poursuit jusqu'au vidage du récipient.
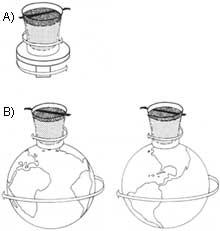
Ce processus ne serait effectué par aucun liquide normal, car d'une part la viscosité empêche le déplacement capillaire des lames du liquide et par la tension superficielle le liquide tend à remplir le plus petit volume possible et d'autre part il devrait dépasser la force de gravité sans recevoir de l'énergie de l'extérieur. On introduit ici le deuxième principe de la thermodynamique, qui consiste en ce que le système auto-emprunté perd toujours de l'énergie, en partant à la situation de plus grand désordre.
Ainsi, He II surpasse tous les inconvénients mentionnés (viscosité, tension superficielle, force de gravité et deuxième principe de la thermodynamique). Le processus approcherait qu'une couche de petite épaisseur du superfluide commence à s'élever par le mur intérieur en le couvrant complètement. En arrivant au bord du bateau commence à descendre par le mur extérieur. En ce moment la couche externe, sous l'influence de la gravité, tire la couche interne, en vidant le récipient. Par conséquent, dans le processus He II dépasse les barrières des liquides normaux mentionnés ci-dessus.
Vous n'aimez pas rotation
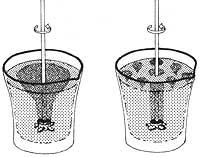
Si nous mettons de l'eau ou tout autre liquide normal dans un récipient et que nous faisons tourner le récipient, verticalement et horizontalement, l'eau commencera également à tourner sur l'axe de rotation et avec la force centrifuge sera formé un tourbillon autour de l'axe. Cela ne se produit pas avec l'hélium II: Si nous faisions tourner le récipient plein d'He II dans la direction verticale ou dans n'importe quelle autre direction, le superfluide resterait immobile.
De plus, non seulement avec le laboratoire, mais aussi avec les étoiles arrêts, jusqu'à ce que le laboratoire lui-même tourne avec la Terre dans l'Espace. Le superfluide est donc complètement arrêté par rapport aux directions fixes qui sont prises comme référence en astronomie. Même si le mouvement du navire dans n'importe quelle direction (bien sûr, il prend en compte des virages et des translations lentes et ne pas s'agiter ou voler le bateau), l'He répond à cette caractéristique. Dans cette expérience, He II est une référence stable à tous les mouvements de l'emballage et se comporte comme une toupie gyroscopique.
Comme l'hélium superfluide n'a pas de viscosité, il n'a ni adhérence ni force résistante au déplacement avec les parois du navire, c'est-à-dire en n'affectant pas l'hélium superfluide, il respecte le principe d'inertie. Voyons d'abord ce que dit ce principe : un point matériel qui n'est influencé par aucune force est arrêté ou se déplace avec un mouvement rectiligne uniforme. En conséquence de ce prince, nous avons la propriété de la matière appelée inertie. Cette propriété indique qu'un corps ne peut pas changer naturellement son état de mouvement ou de repos. Comme aucune force externe par friction n'est transmise à l'hélium superfluide, He II reste immobile selon le principe d'inertie, une fois que l'emballage a commencé à bouger.
D'autre part, si l'hélium superfluide est déplacé, selon le principe d'inertie, il devrait se déplacer avec un mouvement rectiligne uniforme, car, comme indiqué ci-dessus, il n'y a pas de force résistante au déplacement. Cette affirmation peut être prouvée par l'expérience suivante : depuis que l'He II s'est effondré à l'intérieur d'un tube long et fermé, l'He II se déplacera continuellement dans le tube en réalisant un courant interne permanent, de même que les courants électriques permanents se déplacent en superconducteurs.
Comportement face à la chaleur
Lorsque la chaleur se propage facilement à l'intérieur d'un corps, il est dit être un bon conducteur de chaleur. Au contraire, il est un mauvais conducteur de chaleur quand il est difficile d'étendre. Par conséquent, lorsqu'un corps conduit facilement la chaleur présente une conductivité thermique élevée. La conductivité thermique est la propriété qui nous indique comment un corps porte la chaleur.
Dans les fluides, chaque molécule peut se déplacer d'un point à l'autre, c'est-à-dire se déplacer. Par ce mouvement, la chaleur se propage à travers le fluide.
Quand un liquide normal est soumis à une source de chaleur, plus n'importe quel point du liquide de la source de chaleur est près, c'est-à-dire, le liquide est chauffé localement. Ainsi, dans le liquide, des différences sont générées. La chaleur s'étend des points chauds aux plus froids, et plus la différence entre les points est grande, plus rapide et plus rapide.
L'hélium superfluide ne se comporte pas comme il a été dit avant devant la chaleur. D'une part, sa conductivité thermique est infinie, et celle-ci est de plus en plus grande, plus la différence entre les points est faible. D'autre part, en l'absence d'un point chaud au fond de l'hélium superfluide, il ne fait pas bouillir. Cependant, lorsque le chauffage est aromatisé, mais l'évaporation se produit à la surface, le reste du fluide restant à la même température. Dans la pratique, il apparaît donc comme un superchauffeur de chaleur, c'est à dire si de petites différences se produisent, la chaleur se propage rapidement à travers le liquide. Le chauffage ou le refroidissement local est donc pratiquement impossible. Par conséquent, dans le liquide, les inégalités ne peuvent pas se produire.
Pour connaître la propagation de la chaleur à travers l'hélium superfluide a été conçu l'expérience suivante: si dans un bain d'hélium superfluide est introduit un récipient avec des pores et un cou serré, l'hélium superfluide pénètre par les pores, terminant le processus de pénétration lorsqu'ils sont à la même hauteur extérieure et intérieure. Si par la suite on chauffait l'intérieur du récipient avec une résistance électrique, le superfluide qui l'entoure entrerait à travers le mur pour refroidir l'intérieur et maintenir l'équilibre. En raison de la quantité d'hélium qui entre dans l'emballage, le grand jet d'hélium sort du cou de l'emballage pour éliminer la différence de masse.
Les chercheurs ont reconstruit cette expérience en créant de courtes chaleurs à base de résistance électrique. Ces réchauffements provoquent l'expansion de la chaleur comme des vagues à travers la masse liquide. Ces ondes sont appelées échos secondaires. Cette forme de propagation de la chaleur n'est remplie dans aucune autre condition.
En conclusion
Entre autres choses, toutes les expériences effectuées avec 4 He pourraient être effectuées avec 3 He, mais il faudrait travailler à des températures plus froides, 0,001K autour de la température. 3 L'He présente des propriétés très surprenantes: il peut être solidifié sous certaines pressions, mais ne se refroidissant pas, mais se chauffant. De plus, le superfluide 3 He est magnétique, tout comme le fer ou le nickel, et les expériences réalisées montrent deux types: 3A et 3B. 3A La densité de l'hélium (avec une plus grande imantation) est très difficile à calculer en raison de sa variabilité. La densité varie en fonction du champ magnétique qui traverse le superfluide.
Enfin, la situation superflue intéresse profondément les astronomes, car elle explique le comportement des étoiles à neutron. Il y a une couche de neutrons qui n'est pas solide, liquide ou gazeuse, mais superflu. Par conséquent, les études menées dans les laboratoires cryoscopiques nous conduisent à un ciel qui n'est pas affecté par la matière.





