Espoir à l'oubli de la maladie d'Alzheimer
Alzheimer est le type de démence dégénérative le plus fréquent. Il est supporté par des personnes âgées et attentif aux fonctions de renseignement entravant les activités quotidiennes. Les dommages sont persistants et progressifs, limitant au fil du temps l'autonomie du patient. Enfin, en raison des dommages causés aux organes nécessaires à la vie, le malade mène à la mort.
Malheureusement, aujourd'hui, il n'y a aucun moyen de guérir la maladie d'Alzheimer. Les traitements pharmacologiques et non pharmacologiques utilisés servent uniquement à réduire l'évolution de la maladie et à améliorer la qualité de vie du patient et de son environnement.
Maintenant, cependant, le médicament expérimental Aducanumab ouvre ses portes à l'espoir de trouver un traitement qui peut guérir définitivement la maladie d'Alzheimer.
Sur l’origine de la maladie d’Alzheimer
Bien que l'origine de la maladie d'Alzheimer n'est pas encore claire, l'hypothèse du b-amyloïde (bA) est considérée comme la principale raison. En conséquence, l'accumulation de protéines bA dans la tête produit des plaques extracellulaires et internes qui sont toxiques pour le cerveau. C'est probablement parce que le corps produit cette protéine de manière disproportionnée ou ne peut pas être éliminé.
Un facteur important de risque pour Alzheimer est le génétique. Il semble que dans le gène de l'apolipoprotéine E du chromosome 19 se trouve l'une des origines de la maladie, car son quatrième allèle (ApoE4) est lié à la production d'onsA. Mais il y a d'autres facteurs de risque associés à l'apparition de ce type de plaques dans le cerveau, comme l'âge, le style de vie conduit, l'abus des anti-inflammatoires ou l'aluminium.
Aducanumab
Le médicament doucanumab a été développé par l'association américaine Biogen. Il s'agit d'un anticorps humain monoclonal sélectif type IgG1, opposé à celui (Figure 1). La partie variable du médicament est celle obtenue à partir du rat et la partie fixe celle obtenue d'un patient qui a subi un cas particulièrement prolongé d'Alzheimer. Le premier attaquera l'antigène (dans ce cas à l'Antigène), tandis que la partie d'origine humaine servira à empêcher le patient de subir des rejets du système immunitaire.
Selon les scientifiques, même si la maladie d'Alzheimer est diagnostiquée au moment de l'apparition des symptômes, les plaques d'A sont stockées depuis des années dans le cerveau du patient. C'est pourquoi ils croient que tous les tests réalisés jusqu'à présent avec des patients très développés avec Alzheimer ont échoué. Aujourd'hui, cependant, de nouveaux essais cliniques sont en cours avec des patients présentant un faible et un demi-degré de maladie, comme ceux menés avec aducanumab. Le médicament est encore en développement, mais les créateurs ont montré qu'il élimine les plaques A du cerveau de ces patients. Si les recherches sont réussies à l'avenir, l'objectif des essais est de détecter les plaques très tôt et le médecin peut les prescrire comme tout autre médicament.
Premiers résultats
Il ya deux ans, Biogen a lancé l'essai clinique de la phase 1b appelé PRIME. Pendant un an, les injections doucanumab mensuelles étaient administrées aux participants et voulaient connaître leur efficacité, leur sécurité et leur pharmacocinétique.
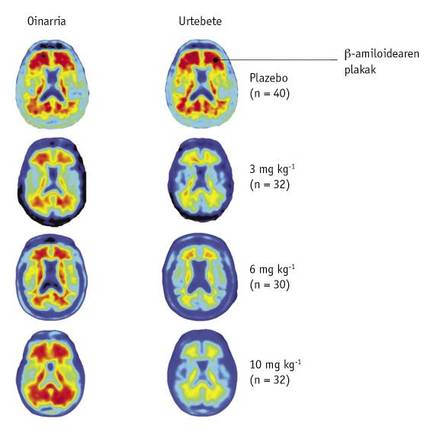
Pour cela, 165 patients ont participé, certains avec placebo et d'autres avec différentes doses de médicament (1, 3, 6 ou 10 mg/kg). L'influence des douaniers a été mesurée par la tomographie d'émission de positons (PET).
Un an plus tard, les images PET des patients ont été comparées à la référence avant le traitement. Dans cette comparaison, les scientifiques ont noté que la diminution des niveaux d'A était clairement observée en fonction de la dose du médicament (figure 2). Les images montrent également que cette descente a eu lieu dans toutes les parties du cerveau.
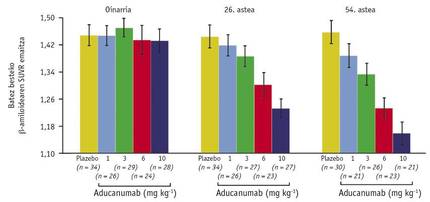
En outre, un autre des résultats obtenus avec ce scanner a jeté une nouvelle satisfaction: l'échelle entre la dose utilisée et la quantité moyenne d'A dans le cerveau (Figure 3). A travers elle, on a pu comparer les niveaux d'A des semaines 26 et 54 avec la référence et on a conclu que l'effet du médicament dépend du temps et de la dose. Cette découverte peut être considérée comme historique, car elle fait penser que pour la première fois la maladie d'Alzheimer peut être guérie. Et comme si tout cela ne suffisait pas, les patients ayant reçu une dose de 10m/kg pour la Semaine 54 avaient un niveau d'attribution de 1.16 très proche de la limite de 1.10 qui discriminait des résultats positifs et négatifs.
Les méthodes dites « Mini Mental State Examination (MMSE) » et « Clinical Dementia Rating (CDR) » ont également été employées, deux méthodes de notation utilisées pour détecter, enregistrer et analyser les évolutions des déficiences cognitives. Dans ces méthodes, le patient doit remplir un questionnaire et selon le score obtenu, le médecin est conscient du degré de démence du patient. Le temps de réponse à toutes les questions varie entre 5 et 10 minutes, donc les analyses des niveaux de démence sont fréquentes. Lors de l'utilisation du MMSE et du CDR dans cette phase 1b, ils ont pu constater que la diminution des niveaux d'A rapporte des avantages.
Du point de vue de la sécurité Aducanumab, il peut être considéré comme un médicament assez sûr. Les effets indésirables les plus fréquents ont été maux de tête, infection urine, infection des voies respiratoires et les soi-disant ARIA (Amyloid-Related Imaging Abnormalities). Ces dernières sont des anomalies trouvées sur les images par résonance magnétique, causées par des oedèmes, des microhémorragies et des sidéroses. Bien que les patients qui ont subi tous ces effets indésirables ont été traités dans les urgences, personne n'a été hospitalisé. Il n'y avait pas non plus de morts.
Enfin, la pharmacocinétique douanière (concentration maximale et surface sous la courbe normale) était linéaire à des doses chez toutes les personnes traitées. La demi-vie biologique dans le plasma est de vingt et un jours. D'autre part, l'anticorps contre aducanumab n'a développé que 3% du total des patients. Et comme l'influence des anticorps a été transitoire et à travers les titres minimums d'anticorps, ils ont conclu qu'ils n'affectent pas la pharmacocinétique et la sécurité des doucanumas.
Pour poursuivre ces résultats, les trois phases de l'essai clinique ont été lancées.
Phases finales des sessions cliniques
La troisième et dernière phase de l'essai clinique est appelée EMERGE et ENGAGE. Ils ont commencé en 2015 et dureront sept ans. Son objectif est de vérifier les résultats de la phase 1b et de poursuivre l'étude de l'efficacité et la sécurité des aducanumab chez les personnes ayant un degré d'Alzheimer bas et moyen.
Pour cela, ils organiseront des sessions avec 3000 patients provenant de 400 hôpitaux du monde entier. Mais cela ne sert pas à ce que tout patient puisse participer à la recherche. Le patient doit remplir un certain nombre de critères pour participer aux tests: Que le scanneur PET ait un résultat positif d'A, permettre l'identification du génotype ApoE4, un score entre 24 et 30 dans la méthode MMSE et un résultat de 0,5 dans la méthode CDR, entre autres. Les patients présentant une histoire clinique d'angine instable ou d'infarctus du myocarde, d'anémie ou de maladie chronique hépatique ou rénale ne peuvent pas participer aux tests.
Dans cette phase, comme dans la précédente, les patients seront injectés différentes doses d'anticorps une fois par mois et en 2022 les résultats de PET, CDR et MMSE seront comparés au placebo.
Suivi depuis la pharmacie
Comme tout autre médicament, nous pouvons également suivre la pharmacie avec aducanumab.
Il s'agit d'un service offert au bureau de pharmacie qui vise à améliorer la qualité de vie du patient. Cela vise à accroître l'efficacité et la sécurité des traitements du patient, en réduisant les risques associés à l'utilisation de médicaments. Le suivi pharmacothérapeutique se fait selon une méthodologie ou une systématique concrète, pour laquelle il est indispensable d'incorporer un pharmacien à l'équipe sanitaire multidisciplinaire qui s'occupe du patient.
Pour effectuer le service, vous devez tenir des entretiens réguliers dans la pharmacie avec le patient ou son soignant. Et dans ces entretiens, nous pouvons réaliser les petits problèmes de santé que la douane peut causer au patient. Notez que les patients atteints d'Alzheimer sont des personnes âgées et des patients avec plusieurs traitements pharmacologiques, ce qui augmente considérablement le risque de nouveaux problèmes de santé. Cela peut provoquer des effets pernicieux des aducanumab par l'effet direct du médicament lui-même ou par l'interaction avec d'autres médicaments. Une fois que ces problèmes de santé détectés dans la pharmacie ont été enregistrés, ils communiqueraient au médecin qui participe à l'essai clinique. Nous prendrons également contact avec votre médecin généraliste si nécessaire. Pour terminer le cycle, lorsque les patients quittent la consultation médicale, une date sera définie pour une nouvelle entrevue.
Ainsi, les pharmaciens peuvent participer et collaborer à cette troisième phase de l'essai pour que le aducanumab soit le médicament définitif contre la maladie d'Alzheimer à l'avenir.
Enfin, il convient de mentionner que ces réunions en pharmacie serviront à suivre la pharmacocinétique du patient à l'avenir. En plus de toutes les informations que nous avons enregistrées, les relations avec le patient et les médecins de différents domaines seront plus étroites, toujours au profit du patient.








