Esperanza al olvido del Alzheimer
El Alzheimer es el tipo de demencia degenerativa más frecuente. Es soportado por personas de la tercera edad y atenta a las funciones de inteligencia dificultando las actividades diarias. El daño es persistente y progresivo, limitando con el tiempo la autonomía del paciente. Finalmente, como consecuencia de los daños causados a los órganos necesarios para la vida, el enfermo lleva a la muerte.
Desgraciadamente, hoy en día no hay forma de curar el Alzheimer. Los tratamientos farmacológicos y no farmacológicos utilizados sólo sirven para reducir la evolución de la enfermedad y mejorar la calidad de vida del paciente y su entorno.
Ahora, sin embargo, el fármaco experimental Aducanumab abre sus puertas a la esperanza de encontrar un tratamiento que pueda curar definitivamente el Alzheimer.
Sobre el origen del Alzheimer
Aunque el origen del Alzheimer aún no está claro, la hipótesis del b-amiloide (bA) se considera la principal razón. Según esto, la acumulación de proteínas bA en la cabeza produce unas placas extracelulares e internas que son tóxicas para el cerebro. Esto es probablemente debido a que el cuerpo produce esta proteína de forma desproporcionada o no puede ser eliminada.
Un factor importante de riesgo para el Alzheimer es el genético. Parece ser que en el gen de la apolipoproteína E del cromosoma 19 se encuentra uno de los orígenes de la enfermedad, ya que su cuarto alelo (ApoE4) se relaciona con la producción de < A. Pero hay otros factores de riesgo asociados a la aparición de este tipo de placas en el cerebro, como la edad, el estilo de vida llevado, el abuso de antiinflamatorios o el aluminio.
Aducanumab
El fármaco aducanumab fue desarrollado por la asociación americana Biogen. Se trata de un anticuerpo humano monoclonal selectivo tipo IgG1, opuesto al < A (Figura 1). La parte variable del fármaco es la obtenida a partir de la rata y la parte fija la obtenida de un paciente que sufrió un caso especialmente prolongado de Alzheimer. El primero atacará al antígeno (en este caso al < A), mientras que la parte de origen humano servirá para evitar que el paciente sufra rechazos del sistema inmunitario.
Según los científicos, aunque el Alzheimer se diagnostica en el momento de la aparición de los síntomas, las placas de < A llevan años almacenándose en el cerebro del paciente. Por eso creen que todas las pruebas realizadas hasta el momento con pacientes con Alzheimer muy desarrollado han fallado. Ahora, sin embargo, se están realizando nuevos ensayos clínicos con pacientes con bajo y medio grado de enfermedad, como los que se están realizando con aducanumab. El fármaco aún está en desarrollo, pero los creadores han demostrado que elimina las placas < A del cerebro de estos pacientes. Si las investigaciones son exitosas en el futuro, el objetivo de los ensayos es detectar las placas muy temprano y que el médico pueda prescribirlas como cualquier otro medicamento.
Primeros resultados
Hace dos años Biogen puso en marcha el ensayo clínico de la fase 1b denominado PRIME. Durante un año, las inyecciones mensuales de aducanumab se administraban a los participantes y quisieron conocer su eficacia, seguridad y farmacocinética.
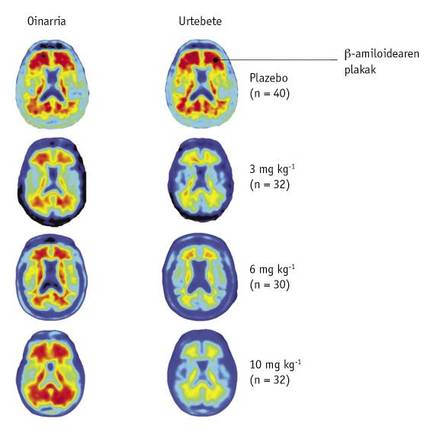
Para ello participaron 165 pacientes, algunos con placebo y otros con diferentes dosis de fármaco (1, 3, 6 ó 10 mg/kg). La influencia de los aduaneros se midió mediante la Tomografía de Emisión de Positrones (PET).
Pasado un año, se compararon las imágenes PET de los pacientes con la referencia previa al tratamiento. En esta comparación, los científicos observaron que la disminución de los niveles de < A se veía claramente en función de la dosis del fármaco (Figura 2). Las imágenes mostraban además que este descenso se produjo en todas las partes del cerebro.
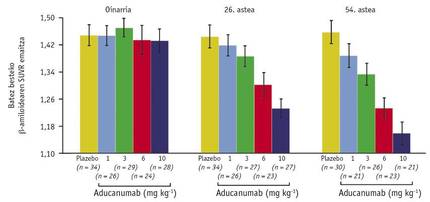
Asimismo, otro de los resultados obtenidos con este escáner arrojó una nueva satisfacción: la escala entre la dosis utilizada y la cantidad media de < A en el cerebro (Figura 3). A través de ella se pudieron comparar los niveles de < A de las semanas 26 y 54 con la referencia y concluyeron que el efecto del fármaco depende del tiempo y de la dosis. Este descubrimiento puede considerarse histórico, ya que hace pensar que por primera vez se puede curar la enfermedad del Alzheimer. Y por si todo esto fuera poco, los pacientes que recibieron una dosis de 10m/kg en la Semana 54, tenían un nivel de<A 1.16 muy cercano al límite de 1.10 que discrimina resultados positivos y negativos.
También se emplearon los métodos denominados “Mini Mental State Examination (MMSE)” y “Clinical Dementia Rating (CDR)”, dos métodos de puntuación utilizados para detectar, registrar y analizar las evoluciones de los deterioros cognitivos. En estos métodos el paciente debe rellenar un cuestionario y dependiendo de la puntuación obtenida, el médico es consciente del grado de demencia del paciente. El tiempo de respuesta a todas las preguntas oscila entre los 5 y los 10 minutos, por lo que son frecuentes los análisis de los niveles de demencia. Al utilizar MMSE y CDR en esta fase 1b, pudieron comprobar que la disminución de los niveles de < A reporta beneficios.
Desde el punto de vista de la seguridad Aducanumab, puede considerarse un fármaco bastante seguro. Los efectos adversos más frecuentes fueron dolor de cabeza, infección de orina, infección del tracto respiratorio y los denominados ARIA (Amyloid-Related Imaging Abnormalities). Estas últimas son anomalías encontradas en las imágenes por resonancia magnética, causadas por edemas, microhemorragias y siderosis. Aunque los pacientes que sufrieron todos estos efectos adversos fueron tratados en urgencias, nadie ha sido hospitalizado. Tampoco hubo muertos.
Por último, la farmacocinética aduanera (concentración máxima y superficie bajo la curva normal) fue lineal a dosis en todas las personas tratadas. La semi-vida biológica en plasma es de veintiún días. Por otro lado, el anticuerpo contra aducanumab sólo desarrolló el 3% del total de pacientes. Y como la influencia de los anticuerpos fue transitoria y a través de los títulos mínimos de anticuerpo, concluyeron que no afectan a la farmacocinética y seguridad de las aducanumas.
Para dar continuidad a estos resultados se pusieron en marcha las tres fases del ensayo clínico.
Fases finales de las sesiones clínicas
La tercera y última fase del ensayo clínico se denomina EMERGE y ENGAGE. Comenzaron en 2015 y durarán siete años. Su objetivo es comprobar los hallazgos de la fase 1b y continuar con el estudio de la eficacia y seguridad de los aducanumab en personas con un grado de Alzheimer bajo y medio.
Para ello, realizarán sesiones con 3.000 pacientes procedentes de 400 hospitales de todo el mundo. Pero no sirve para que cualquier paciente pueda participar en la investigación. El paciente deberá cumplir una serie de criterios para poder participar en las pruebas: Que el escáner PET tenga un resultado positivo de < A, permitir la identificación del genotipo ApoE4, una puntuación entre 24 y 30 en el método MMSE y un resultado de 0,5 en el método CDR, entre otros. Los pacientes con historia clínica de angina inestable o infarto de miocardio, anemia o enfermedad crónica hepática o renal no podrán participar en las pruebas.
En esta fase, como en la anterior, se inyectarán a los pacientes diferentes dosis de anticuerpo una vez al mes y en el año 2022 se compararán los resultados de PET, CDR y MMSE con el placebo.
Seguimiento desde farmacia
Al igual que cualquier otro fármaco, también podemos realizar un seguimiento farmacoterapéutico desde la farmacia con aducanumab.
Se trata de un servicio ofrecido en la oficina de farmacia que tiene como objetivo mejorar la calidad de vida del paciente. Para ello se pretende aumentar la eficacia y seguridad de los tratamientos del paciente, reduciendo los riesgos asociados al uso de medicamentos. El seguimiento farmacoterapéutico se realiza siguiendo una metodología o sistemática concreta, para lo cual es imprescindible la incorporación de un farmacéutico al equipo sanitario multidisciplinar que atiende al paciente.
Para poder llevar a cabo el servicio es necesario mantener entrevistas periódicas en la farmacia con el paciente o su cuidador. Y en estas entrevistas podemos darnos cuenta de los pequeños problemas de salud que la aducanumab puede ocasionar al paciente. Hay que tener en cuenta que los pacientes con Alzheimer son personas mayores y pacientes con múltiples tratamientos farmacológicos, lo que aumenta considerablemente el riesgo de nuevos problemas de salud. Esto puede provocar efectos perniciosos de los aducanumab por el efecto directo del propio fármaco o por la interacción con otros medicamentos. Una vez dejados registrados estos problemas de salud detectados en la farmacia, se comunicarían al médico que participa en el ensayo clínico. También nos pondríamos en contacto con el médico de cabecera si se considera necesario. Para finalizar el ciclo, al salir los pacientes de la consulta médica, se definiría una fecha para una nueva entrevista.
Así, los farmacéuticos podemos participar y colaborar en esta tercera fase del ensayo para que el aducanumab sea el medicamento definitivo contra el Alzheimer en el futuro.
Por último, cabe mencionar que estas reuniones en farmacia servirán para seguir haciendo un seguimiento farmacocinético al paciente en el futuro. Además de toda la información que tengamos registrada, las relaciones con el paciente y con médicos de diferentes ámbitos serán más estrechas, siempre en beneficio del paciente.








