Metano: ¿sólo fuente de energía?
La activación del enlace C-H del metano a nivel industrial, en condiciones ágiles de reacción, es uno de los retos más importantes de la química actual. De hecho, si esta activación fuera posible, el metano sería uno de los compuestos químicos más utilizados, no sólo en la producción de energía, sino en la obtención de hidrógeno molecular y en la síntesis de compuestos químicos más valiosos como alcoholes o hidrocarburos más grandes.
En general, cuando hablamos de activación de alcanos saturados, formados por enlaces C-C y C-H, estamos hablando de romper controladamente uno de sus enlaces C-C o C-H. Este es el primer obstáculo a superar en muchos de los usos de estos compuestos. Estos procesos, sin embargo, son altamente costosos desde el punto de vista energético en condiciones de reacción convencionales, limitando el uso actual de los alcanos saturados a la producción energética por combustión principalmente. Este uso explota la capacidad energética de estos compuestos, pero no la posibilidad de obtener compuestos más útiles y valiosos a partir de este compuesto.
En la medida en que el metano, CH 4, es el más pequeño de los alcanos saturados, se puede decir que su activación tiene ciertas particularidades. Por un lado, en la medida en que los cuatro hidrógenos del metano son equivalentes, su activación no conlleva problemas de selectividad habituales en estos casos, ya que el producto será el mismo. Por otro lado, siendo los enlaces C-H más fuertes en los alcanos los de los carbonos de las esquinas, está claro que el metano es un caso extremo.
Asimismo, para comprender la importancia de la activación de este compuesto, principal componente del gas natural, conviene tener en cuenta su origen. De hecho, el metano aparece como un producto de descomposición anaeróbica de la materia orgánica y del metabolismo de los microorganismos metanogénicos, por lo que existen en el mundo grandes reservas naturales de metano, estimándose que la cantidad mundial de metano es el doble que los residuos fósiles.
Gran parte de estas reservas naturales se concentran en suelos de océanos y lagos como hidratos de metano. Por ello, el metano se conoce a menudo como el gas de los lagos. Estos hidratos de metano son clatratos de metano formados en condiciones de baja temperatura y alta presión, estructuras abiertas formadas por moléculas de agua que albergan una molécula de metano.
Se estima que más de la mitad del metano y el gas natural se encuentran en estado metano-hidrato a nivel mundial. Así, muchos países están investigando y estudiando la posibilidad de utilizar este hidrato de metano como combustible.
Además de los suelos de los océanos y lagos, en las primeras capas de la corteza terrestre existen grandes reservas de metano adsorbidas en las venas de carbón. Así, en muchos países se utiliza este metano para reducir la dependencia del petróleo. No obstante, el uso de este metano también conlleva riesgos. Esto se debe a que es necesario utilizar grandes cantidades de agua para reducir la presión y liberar el gas de los poros. Esto, además de reducir los niveles de agua de los acuíferos, puede provocar contaminación del agua.
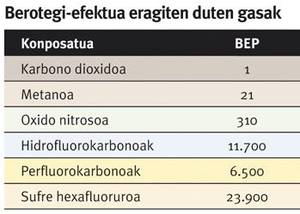
Además de los dos riesgos mencionados, en la actualidad existe otro que ha adquirido una gran atención. De hecho, el potencial efecto invernadero del metano (PIR) es 21 veces mayor que el del dióxido de carbono. Por ello, en la explotación de los diferentes tipos de provisiones naturales de metano es necesario adoptar medidas para evitar la fuga de gases a la atmósfera, lo que podría incrementar el cambio climático.
En este sentido, en muchas zonas ganaderas, vertederos y depuradoras con alta producción de metano, en lugar de liberar a la atmósfera el metano generado, se recoge y se utiliza en la producción de energía. De esta forma, sin embargo, se genera dióxido de carbono, principal responsable del cambio climático a pesar de tener un PIR inferior al metano. La activación del metano puede ser la clave para solucionar este problema.
El potencial efecto invernadero (PEP) refleja la capacidad de un gas para provocar el efecto invernadero. Se utiliza como referencia el dióxido de carbono, y el valor PIR de un gas indica el número de veces que una determinada concentración mantiene el calor del sol en la atmósfera por encima de la misma concentración de dióxido de carbono.
Buscando los catalizadores más adecuados
Volviendo a la activación del metano, para reducir las necesidades energéticas asociadas a la rotura de su enlace C-H, se utilizan catalizadores en el laboratorio. De hecho, en la mayoría de las investigaciones actuales se utilizan compuestos de metales de transición que aparecen en el bloque central de la tabla periódica. Decimos compuestos porque los metales de transición pueden utilizarse de diferentes formas: como átomos neutros, como cationes, como clústeres o como estructuras de varios átomos de metal, o como átomos de metal unidos a otros elementos no metálicos. Precisamente, en el camino hacia la activación del metano industrial, la clave está en encontrar el catalizador más adecuado.
Los metales de transición suelen tener otras estructuras posibles próximas a la estructura o estado electrónico de su nivel energético más bajo, es decir, a la forma de distribuir los electrones a través de la molécula, y a la hora de investigar la activación de metano con estos catalizadores es necesario tener en cuenta estas situaciones. Esto se debe a que, a pesar de que una situación electrónica se encuentra a un nivel de energía superior al otro, es posible que tenga una estabilidad suficiente y que en este caso la reacción se produzca.
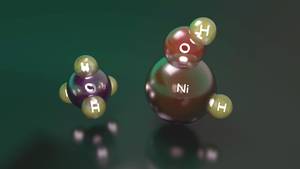
Un ejemplo claro de ello es la reacción entre el níquel hídrido hidróxido catión y metano. En efecto, aunque este compuesto puede activar el metano, cuando se encuentra en su estado más bajo de energía, parece un complejo entre el níquel catión y el agua que no tiene la capacidad de activarlo. Por el contrario, cuando el nivel energético es mayor, la cantidad de energía que necesita el hidrógeno para pasar del níquel al oxígeno es mayor, por lo que tiene una estabilidad suficiente como para activar el metano antes de proporcionar un complejo inreactivo entre el níquel catión y el agua.
Si bien el reactivo de este segundo estado tiene un nivel de energía superior al del primer estado, es capaz de mantenerlo en ese estado electrónico. Sin embargo, al llegar a un intermediario de la vía de reacción, ambas situaciones se convierten en intercambiables y, al pasar de la situación inicial a la estable, se produce un complejo entre el catión de níquel y el agua, terminando la reacción. Por ello, aunque el níquel hídrido hidróxido catión es capaz de activar el metano, se consigue un rendimiento de reacción muy bajo, es decir, de los reactivos que inician la reacción sólo unos pocos consiguen activar el metano.
A medida que descendemos en la Tabla Periódica, la estabilidad del estado más bajo de energía aumenta. En esta situación, en el caso del platino que es el átomo más grande del grupo del níquel, puede pensarse que los platinos hidróxido y sulfhídrido cationes (HP tOH+ y HP tSH+) pueden reaccionar con el metano, ya que se ha demostrado que son suficientemente estables en su estado fundamental.
Teniendo en cuenta el ejemplo del catión níquel hídrido hidróxido, y siendo posible la activación del metano en la situación más baja de la energía, se estima que aumenta la probabilidad de obtener mayores rendimientos de reacción. De hecho, en este caso no es posible pasar a un estado en el que el sistema presenta un nivel de energía inferior y no presenta una estabilidad suficiente para reaccionar con el metano.
Para asegurar que estos compuestos de platino activan el metano, habría que investigar esta reacción por sí mismo, ya que es posible que estos dos catalizadores no sean suficientes para activar el metano. A pesar de que este estudio no se ha llevado a cabo aún, es conocido que el catión de platino activa el metano en condiciones de reacción leves, y se ha observado que la adición a un metal de transición de grupos de hidrido (-H), hidróxido (-OH) o sulfhídrido (-SH) aumenta la reactividad del metal respecto al metano. Por tanto, estos compuestos pueden ser adecuados para seguir investigando.
Para terminar, descartaremos ejemplos concretos y volveremos al problema del cambio climático. En las reacciones entre estos metales de transición compuestos y el metano a menudo se libera hidrógeno molecular. Así, como se ha comentado anteriormente, si la activación del metano fuera posible, el metano podría ser utilizado como fuente de H2, y al tratarse de un combustible que no genera dióxido de carbono, esto permitiría obtener un combustible "limpio" a partir de un compuesto con un alto potencial de efecto invernadero.