Metà: només font d'energia?
L'activació de l'enllaç C-H del metà a nivell industrial, en condicions àgils de reacció, és un dels reptes més importants de la química actual. De fet, si aquesta activació fos possible, el metà seria un dels compostos químics més utilitzats, no sols en la producció d'energia, sinó en l'obtenció d'hidrogen molecular i en la síntesi de compostos químics més valuosos com a alcohols o hidrocarburs més grans.
En general, quan parlem d'activació d'alcans saturats, formats per enllaços C-C i C-H, estem parlant de trencar controladament un dels seus enllaços C-C o C-H. Aquest és el primer obstacle a superar en molts dels usos d'aquests compostos. Aquests processos, no obstant això, són altament costosos des del punt de vista energètic en condicions de reacció convencionals, limitant l'ús actual dels alcans saturats a la producció energètica per combustió principalment. Aquest ús explota la capacitat energètica d'aquests compostos, però no la possibilitat d'obtenir compostos més útils i valuosos a partir d'aquest compost.
En la mesura en què el metà, CH 4, és el més petit dels alcans saturats, es pot dir que la seva activació té certes particularitats. D'una banda, en la mesura en què els quatre hidrògens del metà són equivalents, la seva activació no comporta problemes de selectivitat habituals en aquests casos, ja que el producte serà el mateix. D'altra banda, sent els enllaços C-H més fortes en els alcans els dels carbonis de les cantonades, és clar que el metà és un cas extrem.
Així mateix, per a comprendre la importància de l'activació d'aquest compost, principal component del gas natural, convé tenir en compte el seu origen. De fet, el metà apareix com un producte de descomposició anaeròbica de la matèria orgànica i del metabolisme dels microorganismes metanogénicos, per la qual cosa existeixen en el món grans reserves naturals de metà, estimant-se que la quantitat mundial de metà és el doble que els residus fòssils.
Gran part d'aquestes reserves naturals es concentren en sòls d'oceans i llacs com a hidrats de metà. Per això, el metà es coneix sovint com el gas dels llacs. Aquests hidrats de metà són clatratos de metà formats en condicions de baixa temperatura i alta pressió, estructures obertes formades per molècules d'aigua que alberguen una molècula de metà.
S'estima que més de la meitat del metà i el gas natural es troben en estat metà-hidrato a nivell mundial. Així, molts països estan investigant i estudiant la possibilitat d'utilitzar aquest hidrat de metà com a combustible.
A més dels sòls dels oceans i llacs, en les primeres capes de l'escorça terrestre existeixen grans reserves de metà adsorbidas en les venes de carbó. Així, en molts països s'utilitza aquest metà per a reduir la dependència del petroli. No obstant això, l'ús d'aquest metà també comporta riscos. Això es deu al fet que és necessari utilitzar grans quantitats d'aigua per a reduir la pressió i alliberar el gas dels porus. Això, a més de reduir els nivells d'aigua dels aqüífers, pot provocar contaminació de l'aigua.
A més dels dos riscos esmentats, en l'actualitat existeix un altre que ha adquirit una gran atenció. De fet, el potencial efecte d'hivernacle del metà (PIR) és 21 vegades major que el del diòxid de carboni. Per això, en l'explotació dels diferents tipus de provisions naturals de metà és necessari adoptar mesures per a evitar la fugida de gasos a l'atmosfera, la qual cosa podria incrementar el canvi climàtic.
En aquest sentit, en moltes zones ramaderes, abocadors i depuradores amb alta producció de metà, en lloc d'alliberar a l'atmosfera el metà generat, es recull i s'utilitza en la producció d'energia. D'aquesta forma, no obstant això, es genera diòxid de carboni, principal responsable del canvi climàtic malgrat tenir un PIR inferior al metà. L'activació del metà pot ser la clau per a solucionar aquest problema.
El potencial efecte d'hivernacle (PEP) reflecteix la capacitat d'un gas per a provocar l'efecte d'hivernacle. S'utilitza com a referència el diòxid de carboni, i el valor PIR d'un gas indica el nombre de vegades que una determinada concentració manté la calor del sol en l'atmosfera per sobre de la mateixa concentració de diòxid de carboni.
Buscant els catalitzadors més adequats
Tornant a l'activació del metà, per a reduir les necessitats energètiques associades al trencament del seu enllaç C-H, s'utilitzen catalitzadors en el laboratori. De fet, en la majoria de les recerques actuals s'utilitzen compostos de metalls de transició que apareixen en el bloc central de la taula periòdica. Diem composts perquè els metalls de transició poden utilitzar-se de diferents formes: com a àtoms neutres, com a cations, com a clústers o com a estructures de diversos àtoms de metall, o com a àtoms de metall units a altres elements no metàl·lics. Precisament, en el camí cap a l'activació del metà industrial, la clau està a trobar el catalitzador més adequat.
Els metalls de transició solen tenir altres estructures possibles pròximes a l'estructura o estat electrònic del seu nivell energètic més baix, és a dir, a la manera de distribuir els electrons a través de la molècula, i a l'hora d'investigar l'activació de metà amb aquests catalitzadors és necessari tenir en compte aquestes situacions. Això es deu al fet que, a pesar que una situació electrònica es troba a un nivell d'energia superior a l'altre, és possible que tingui una estabilitat suficient i que en aquest cas la reacció es produeixi.
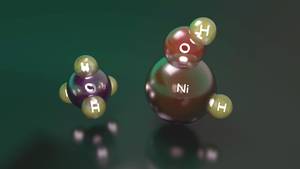
Un exemple clar d'això és la reacció entre el níquel hídrido hidròxid catió i metà. En efecte, encara que aquest compost pot activar el metà, quan es troba en el seu estat més baix d'energia, sembla un complex entre el níquel catió i l'aigua que no té la capacitat d'activar-ho. Per contra, quan el nivell energètic és major, la quantitat d'energia que necessita l'hidrogen per a passar del níquel a l'oxigen és major, per la qual cosa té una estabilitat suficient com per a activar el metà abans de proporcionar un complex inreactivo entre el níquel catió i l'aigua.
Si bé el reactiu d'aquest segon estat té un nivell d'energia superior al del primer estat, és capaç de mantenir-lo en aquest estat electrònic. No obstant això, en arribar a un intermediari de la via de reacció, totes dues situacions es converteixen en intercanviables i, en passar de la situació inicial a l'estable, es produeix un complex entre el catió de níquel i l'aigua, acabant la reacció. Per això, encara que el níquel hídrido hidròxid catió és capaç d'activar el metà, s'aconsegueix un rendiment de reacció molt baix, és a dir, dels reactius que inicien la reacció només uns pocs aconsegueixen activar el metà.
A mesura que descendim en la Taula periòdica, l'estabilitat de l'estat més baix d'energia augmenta. En aquesta situació, en el cas del platí que és l'àtom més gran del grup del níquel, pot pensar-se que els platins hidròxid i sulfhídrido cations (HP tOH+ i HP tSH+) poden reaccionar amb el metà, ja que s'ha demostrat que són prou estables en el seu estat fonamental.
Tenint en compte l'exemple del catió níquel hídrido hidròxid, i sent possible l'activació del metà en la situació més baixa de l'energia, s'estima que augmenta la probabilitat d'obtenir majors rendiments de reacció. De fet, en aquest cas no és possible passar a un estat en el qual el sistema presenta un nivell d'energia inferior i no presenta una estabilitat suficient per a reaccionar amb el metà.
Per a assegurar que aquests compostos de platí activen el metà, caldria investigar aquesta reacció per si mateix, ja que és possible que aquests dos catalitzadors no siguin suficients per a activar el metà. A pesar que aquest estudi no s'ha dut a terme encara, és conegut que el catió de platí activa el metà en condicions de reacció lleus, i s'ha observat que l'addició a un metall de transició de grups d'hidrido (-H), hidròxid (-OH) o sulfhídrido (-SH) augmenta la reactivitat del metall respecte al metà. Per tant, aquests compostos poden ser adequats per a continuar investigant.
Per a acabar, descartarem exemples concrets i tornarem al problema del canvi climàtic. En les reaccions entre aquests metalls de transició composts i el metà sovint s'allibera hidrogen molecular. Així, com s'ha comentat anteriorment, si l'activació del metà fos possible, el metà podria ser utilitzat com a font d'H2, i en tractar-se d'un combustible que no genera diòxid de carboni, això permetria obtenir un combustible "net" a partir d'un compost amb un alt potencial d'efecte d'hivernacle.