Nanomedikamentuak bularreko minbiziaren tratamendu gisa
Emakumeetan heriotza gehien eragiten duen gaixotasuna da bularreko minbizia. Minbiziari aurre egiteko egun erabiltzen diren terapiak, gehienbat, kimioterapia eta erradioterapia dira [1, 2], eta teknika oso inbaditzaileak izanik, eragin desiragaitz ugari sorrarazten dituzte [3]. Kimioterapia konbentzionalak organismo osoan eragiten du, minbizi-zelulak nahiz zelula osasuntsuak kaltetuz. Horregatik, kimioterapiaren dosia mugatu egiten da, oso tratamendu toxikoa baita. Nanopartikulak baliabide terapeutiko egokiak izan daitezke kimioterapia konbentzionalaren espezifikotasun-falta hori gainditzeko [4].
Hala, nanopartikulen bidez, posible da minbiziaren aurkako farmakoa eragite-lekuan bertan askatzea edo itu-ehunean kontzentratzea, toxikotasun sistemikoa murriztuz. Gainera, zenbait farmakoren arazoak ere konpontzen dituzte, hala nola disolbagarritasun eskasa eta ezegonkortasun kimikoa. Horrez gain, farmakoen farmakozinetika hobetzen da, eta kimioterapian erabiltzen diren farmakoen erresistentziak murrizten [5]. Horren guztiaren ondorioz, bularreko minbizia tratatzeko garatu diren nanoteknologiek eraginkortasun handiagoa eta biziraupen hobea izatea lortu dute bularreko minbizia duten gaixoetan, eta kimioterapiaren eragin desiragaitzak murriztea.
Nanopartikulen ezaugarriak eta eragite-mekanismoak
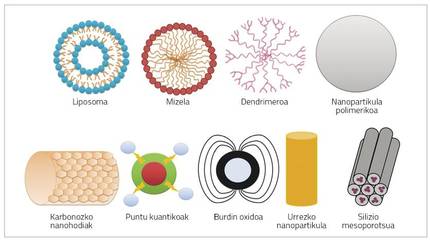
Nanopartikulak oso tamaina txikiko (< 100 nm) partikulak dira, eta hainbat materialez osatuta egon daitezke, hala nola polimeroak, lipidoak, birusak nahiz konposatu organometalikoak (1. irudia) [6].
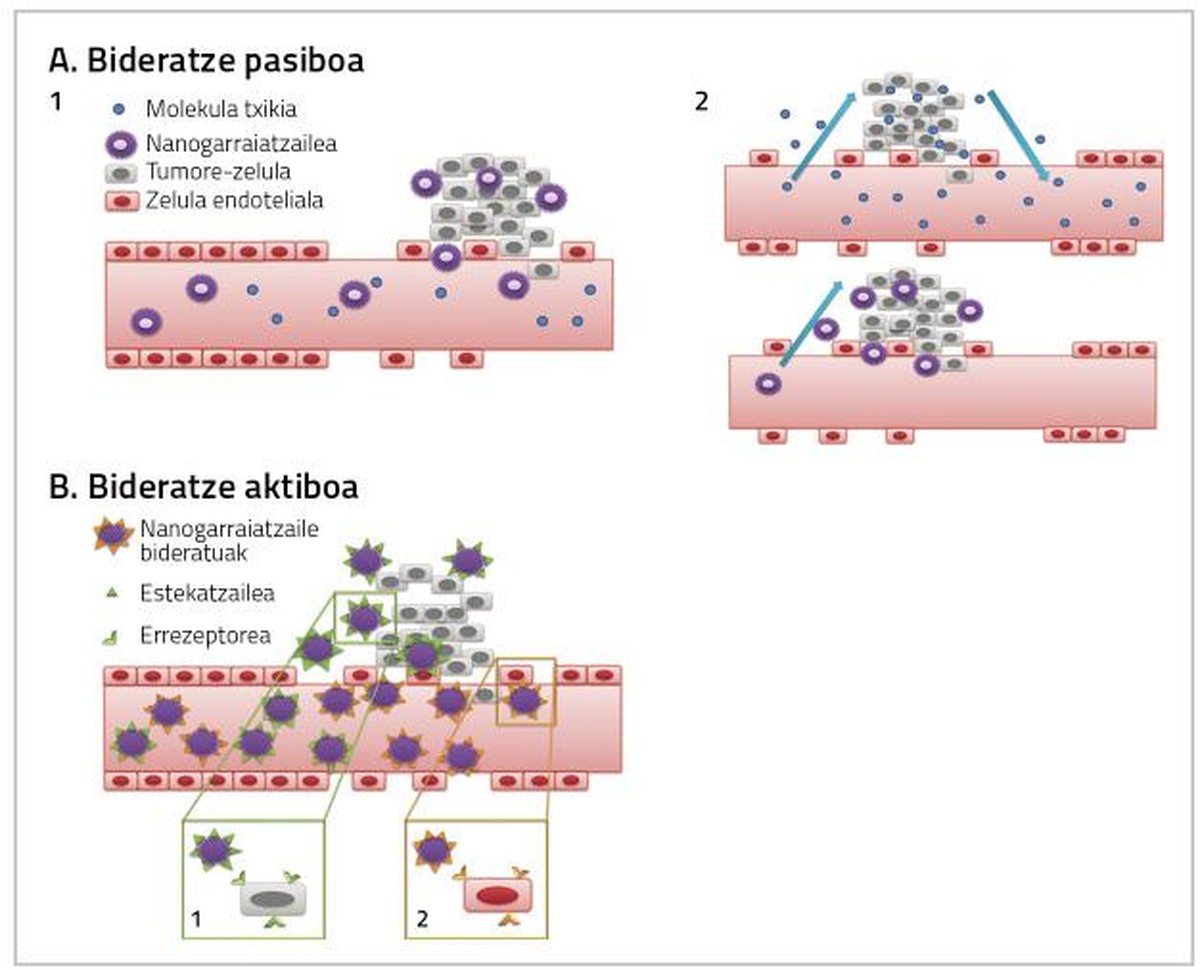
Bularreko minbizia tratatzeko erabiltzen diren medikamentuak guztiz eraginkorrak izateko, bi faktore hartu behar dira kontuan. Batetik, tumorea dagoen ehunera ahalik eta medikamentu-dosi handiena iristea, eta, bestetik, ehunera iristen den medikamentuak zuzenean minbizi-zelulei eragitea. Bi ekintza horiek nanopartikula bidezko bideratze pasibo edo aktiboen bidez gerta daitezke (2. irudia) [4].
Bideratze pasiboa
Farmakoa modu ez-aktibo batean administratzen da, eta tumore-ehunera ailegatzean, metabolizatu, aktibatu eta farmako oso toxikoa bihurtzen da [7, 8, 9]. Bideratze pasiboa hiru modutara egin daiteke:
a) Odol hodien iragazkortasuna handitzea eta erretentzio-efektua (EPR)
Tumore-zelulak eta tumore-ehunak handitzen diren heinean, beren oxigeno eta mantenugaien beharra ere handitu egiten da. Oxigeno- eta mantenugai-behar horiek asetzeko, odol-kapilarren sistema berri bat sortzen da, baina sistema hori ez da guztiz garatzen eta, ondorioz, iragazkorragoa bihurtzen da tamaina jakineko zenbait partikularentzat. Horregatik pilatu ohi dira nanopartikulak tumore-zeluletan, eta, horrela, minbizi-zelulen barnean eragingo duen medikamentu-dosia handitu daiteke, zelula osasuntsuetan toxikotasunik eragin gabe [4, 8].
b) Tumorearen mikroingurunea
Estrategia honek tumorearen ingurunea hartzen du kontuan. Farmakoa tumorearen molekula espezifiko batekin konjugatuta ematen zaio pazienteari (era ez-aktiboan), eta, tumorera ailegatzean, tumorearen inguruak substantzia aktibo bilakatzen du [10].
c) Farmakoa tokian bertan ematea
Farmako kimioterapeutikoa tumorean zuzenean ezartzeak toxikotasun sistemikoa saihesten du, eta, gainera, horri esker, farmakoaren dosiaren murriztu egin daiteke. Adibidez, C mitomizina- dextrano konjugatua tumore barnean emanez, ikusi zen tumorearen gunean minbiziaren aurkako farmakoaren kontzentrazioa handiagoa zela eta toxikotasun sistemikoa murriztu zela [8].
Bideratze aktiboa
Bideratze aktiboaren helburua da nanopartikula konjugatuak eta tratamenduaren helburu den eremuaren ituak elkarri eragitea; hala, medikamentuaren dosi handiagoa iritsiko da minbizi-ehunera (2. irudia).
Minbizi-zelulek ehun osasuntsuen antzeko ezaugarriak dituzte. Horregatik, zelula horiek bereizteko, minbizi-zeluletan gainespresatzen diren errezeptoreekiko espezifikoak diren estekatzaileak erabiltzen dira, eta elkarrekintza espezifikoak sortzen. Lektina-karbohidrato, estekatzaile-errezeptore eta antigeno-antigorputzen loturak dira adibide horietako batzuk [8, 9, 11].
a) Karbohidratoei zuzenduriko bideratzea
Adibide garrantzitsuenetariko bat lektina-karbohidratoarena da. Tumore-zelulen gainazalean aurkitzen diren karbohidratoak ez dira zelula normalenak bezalakoak. Lektina gai da zelulen gainazalean dauden glikoproteinak ezagutzeko eta glikoproteina horiekin elkartzeko. Ondorioz, zenbait karbohidrato lektinekin elkarrekintzan aritzen dira, zelula lotura espezifikoak sortuz. Lektinak, beraz, farmakoa helburu den zelula edo ehunetara bideratzeko molekulak izan daitezke. Lektina-karbohidrato lotura horren bidez, bi nanopartikula ezberdin garatu daitezke. Batetik, lektinak nanopartikuletan txertaturik joan daitezke, eta helburu diren zelulen gainazalean dauden karbohidratoekin elkarrekintzan aritzen dira. Horri lektinen zuzeneko bideratze deritzo. Bestetik, karbohidratoak nanopartikuletan txertaturik daude, helburu diren zeluletan dauden lektinekin elkarrekintzan aritzeko. Horri lektinen alderantzizko bideratze deritzo [4].
b) Errezeptoreen bideratzea
Farmakoa garraiatzaile polimeriko batekin konjugatzen da, eta garraiatzaile hori zeluletara lotzen da egituran daraman estekatzaile bati esker [12]. Folato-errezeptorea da horren adibideetako bat. Zelulen gainazalean folatoei zuzendutako konjugatu bat folato-errezeptoreei elkartzen zaienean, mintz plasmatikoak errezeptorearen konjugatu hori eta estekatzailea biltzen ditu endosoma bat sortuz. Endosoma barneko pH-a azidifikatzen da, eta lisozimak aktibatzen doazen heinean, farmakoa konjugatutik askatzen doa eta zitoplasman sartzen da. Bitartean, askatutako folato-errezeptorea mintz plasmatikora bueltatzen da prozesua berriro hasteko [4].
d) Antigorputzen bideratzea
Estrategia hau antigorputz monoklonalen ekintzaz baliatzen da nanopartikulak tumore-ehunera bideratzeko [12]. Horren adibideetako bat dira immunoliposomak. Antigorputzez konjugatutako liposomek lotura espezifikoa eratzen dute itu-zelulen gainazaleko antigenoarekin, eta lotura horren bidez, tumore-ehunera iristen da minbiziaren aurkako farmakoa (2. irudia) [13].
Amaierako gogoetak
Aukera horiek ikusirik, aurresan daiteke nanomedikamentu horiek oso eraginkorrak izango direla. Hala ere, nanomedikamentu gutxi daude merkaturatuta, eta, oraindik ere, merkaturatzeko dauden asko entsegu klinikoetan edo fase aurreklinikoetan daude. Horrek denbora asko eta finantzaketa handia eskatzen duen arren, nanopartikulek ekarri ditzaketen onurak ikusita, kontuan hartu beharrekoa da haien garrantzia. Horregatik, ezinbestekoa izango da ikerketa gehiago egitea eta nanopartikula berriak garatzea, teknologia farmazeutikoan eta osasun-arloan aurrerapauso handiak emateaz gain, gizarteari ikaragarrizko onura ekarri diezaioketelako.
Bibliografia
Idatzi zuk zeuk Gai librean atalean
Gai librean aritzeko, bidali zure artikulua aldizkaria@elhuyar.eus helbidera
Hauek dira Gai librean atalean Idazteko arauak
Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia







