Erlatibitatearekin zorretan
Argiaren abiadura gaindiezina izanik ere, balio horretatik gertu ibiltzeak dakartzan efektu erlatibistek eguneroko bizitzan ondorio zuzena daukate. Esate baterako, efektu horiek dira bitxigintza munduan hain preziatua den urrearen kolorearen, eta termometroetan erabiltzen den merkurioaren izaera likidoaren erantzule nagusiak. Zer dira baina efektu erlatibista horiek, eta zer erlazio dago efektu horien eta aipaturiko metalen ezaugarri bereizgarri horien artean?
300.000 km/s: abiadura itzela da hori. Adibide batzuk ipintze aldera, abiadura horretan, segundo bakarrean munduari zazpi bira emango genizkioke, edo Ilargitik Lurrerako distantzia ia segundo bakarrean osatuko genuke. Dudarik gabe, abiadura horiek ez daude gure esku. Esate baterako, duela gutxi Martera iritsi zen Curiosity espaziontzia; batez beste 12.000 km/h-ko abiaduran joan zen, eta hori argiaren abiadura baino 90.000 aldiz txikiagoa da.
Edonola ere, mundu atomikoan badira abiadura horretara, horrek dakartzan ondorioak nozitzeraino hurbiltzen diren partikulak. Hala, atomo astunen kasuan (hala nola platinoa, urrea, merkurioa edo uranioa) nukleoan pilatzen den karga positibo handiaren ondorioz, nukleotik hurbilen dauden elektroiak oso azkar mugitzen dira, argiaren abiaduratik gertu.
Einstein-en erlatibitatearen teoriatik ondoriozta daitekeen eran, kasu horietan elektroiaren masa handitu egiten da, eta, hain zuzen ere, hori da atomo astunen kasuan ikusten diren efektu erlatibisten sorburu nagusia. Izan ere, nukleotik gertu dauden elektroien masa handitzean, horien orbitalak txikitu egiten dira. Horrek, era berean, atomo baten kimikan parte hartzen duten azaleko orbital batzuen uzkurtzea eta besteen zabaltzea eragiten du, eta haietan dauden elektroien energia-maila aldatzea. Hala, elektroiek energia-maila batetik bestera igarotzeko xurgatu behar duten energia-maila handitu edo txikitu egin daiteke.
Atomo astunen azaleko orbitalen uzkurtzeak eta zabaltzeak, eta horren ondorioz energia-maila aldatzeak, bestela agertuko ez ziratekeen elementu astunen propietateak eragiten dituzte.
Urrearen kolorea
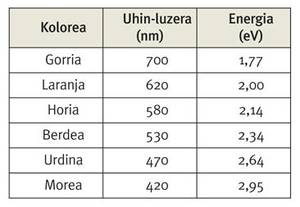
Ezaugarri horietako bat da bitxigintzan hainbesteko balioa duen urrearen berezko kolorea. Izan ere, kasu honetan, azaleko orbitalen zabaltze eta uzkurtze horien ondorioz, azaleko elektroi bat orbital edo energia-maila batetik bestera igarotzen da. Hain zuzen ere, elektroi horrek aipaturiko jauzi hori emateko xurgatu behar duen energia 2,7 eV ingurukoa da, eta balio hori argi morearen eta urdinaren energien artean dago.
Urrearen horitasuna ulertzeko, kontuan hartu behar da kolore hori morearen osagarria dela; alegia, argi zuriari osagai morea kentzen badiogu, guk horia ikusten dugu, eta alderantziz.
Beraz, urrea argi zuriz irradiatzen dugunean, horrek kolore urdinaren eta morearen arteko fotoiak xurgatzen ditu, eta guk urre-gainazal horretan islatzen den gainerako argia ikusten dugu.
Baina zer erlazio dago horren guztiaren eta efektu erlatibisten artean? Azter dezagun, bada, orbital batetik besterako jauzi horri dagokion energia-tartea zenbatekoa den urrearen pareko elementu arinagoetan, hau da, taula periodikoan urrearen gainean dauden kobrearen eta zilarraren kasuan. Hala, kobrearen kasuan energia-tarte hori 1,4 eV ingurukoa da, eta zilarraren kasuan, berriz, 3,7 eV ingurukoa. Ohartu zaitez bi balio horiek argi ikusgaiaren energia-tartetik at geratzen direla. Kobrearen eta zilarraren kasuan, efektu erlatibistak ez dira hain garrantzitsuak; baina, efektu horiek egon ezean, taula periodikoan behera goazen heinean, aipaturiko jauzi horri dagokion energia-tartea handitu egin beharko litzateke. Hala, efektu erlatibista horiek existituko ez balira, urrearen kasuan aipaturiko elektroiak beste bi kasuetan baino energia handiagoa xurgatu beharko luke jauzi hori emateko. Errealitatean, ordea, jauzi horretan jokoan sartzen diren orbital edo energia-mailak elkarrengandik behar luketena baino hurbilago egotea eragiten dute efektu erlatibistek, beren arteko tartea, kobrearen eta zilarraren artean kokatuz. Kasualitatez, gure begien gozamenerako, urrearen kasuan energia-jauzi hori argi morearen energia-mailatik hurbil geratzen da, eta guk kolore horia hautematen dugu.
Merkurio likidoa
Beste adibide esanguratsu bat merkurioarena da. Tenperatura nahiz presioa neurtzeko aparailuetan erabiltzen den metal hori bitxia da, beste metal guztiak ez bezala, likidoa baita giro-tenperaturan. Eta ñabardura hori ere efektu erlatibisten ondorio zuzena da.
Izan ere, bi elektroiz okupaturik dagoen merkurioaren azaleko azken orbitalaren uzkurtzeak eragiten du han dauden elektroiak nukleoari efektu erlatibistarik ezean leudekeena baino gogorrago lotuta egotea. Orbital horren uzkurtzeak ezaugarri horretan duen eragina argiago ikusiko dugu baldin eta merkurioaren ionizazio-energia, hau da, elektroi bat kentzeko behar den energia, haren parekoak baina arinagoak diren kadmioarenarekin eta zinkarenarekin konparatzen badugu. Hala, kontuan hartuta bi lerro gorago dagoen zinkaren ionizazio energia 9,42 eV dela eta justu merkurioaren gainean dagoen kadmioarena 9,03 eV dela, merkurioarena bi balio horiek baino txikiagoa izatea espero beharko litzateke. Aipaturiko orbitalaren uzkurtzeak, ordea, merkurioaren ionizazio-energia 10,51 eV ingurukoa izatea eragiten du, bere taldeko beste biena baino dezente handiagoa, alegia.
Merkurioa giro-tenperaturan likidoa izateak honekin guztiarekin duen zerikusia ulertzeko, metal solidoen egitura gogora ekartzea komeni da. Hala, solido-egoeran daudenean, metalek sobera dituzten elektroiak askatu egiten dituzte, eta atomo guztiei dagozkien elektroi-bandak sortu. Beraz, metal batean nukleoa eta barruko elektroiak puntu jakin batean kokatzen dira, eta askatzen dituzten elektroiek metal osoan zehar puntu zehatz horien inguruan mugitzeko askatasuna izaten dute. Hain zuzen ere, egitura hori da metalen eroankortasun elektriko nahiz termiko handiaren erantzule nagusia.
Merkurioaren kasuan, aldiz, okupaturik dagoen azken orbitalaren uzkurtzeak egitura hori izatea galarazten du, bertako bi elektroiak ezin baitira libre gelditu, efektu erlatibista hori izan ezean gertatuko litzatekeen moduan. Horren ondorioz, merkurioa egoera likidoan egoten da giro-tenperaturan.
...eta askoz gehiago
Dena den, urrearen horitasuna eta merkurioaren izaera likidoa efektu erlatibisten ondorioen bi adibide baino ez dira. Izan ere, bi kasu horietatik harago, efektu horiek asko baldintzatzen dute elementu astunen kimika. Hala, efektu erlatibistek posible egiten dute elementu astun horiek bestela emango ez zituzketen erreakzioak ematea. Halaber, elementu astunen eta haien pareko arinagoen (platinoa/paladioa, urrea/zilarra, merkurioa/kadmioa...) portaera kimiko ezberdina, neurri batean efektu horiei zor zaie.
Hortaz, argiaren abiadurak fikzio-kontua dirudien arren, harekin erlazionaturiko efektuak oso presente dauzkagu gure eguneroko bizitzan. Beraz, esan genezake, hein batean bada ere, gizakiok efektu erlatibista horiekin zorretan gaudela.
Bibliografia
Idatzi zuk zeuk Gai librean atalean
Gai librean aritzeko, bidali zure artikulua aldizkaria@elhuyar.eus helbidera
Hauek dira Gai librean atalean Idazteko arauak